Средства диагностики DirectX. Очень хороший самоучитель пользователя компьютером. Как самому устранить 90% неисправностей в компьютере и увеличить его возможности
Читайте также
7.4. Эффективные средства диагностики сети
7.4. Эффективные средства диагностики сети Диагностика с помощью Центра управления сетями и общим доступомПервичную диагностику работы сети можно выполнить, просто взглянув на значок текущего подключения в области уведомлений или на карту сети в Центре управления
10.3. Средства диагностики системы
10.3. Средства диагностики системы
Монитор надежности и производительностиВ Windows Vista имеется новое средство наблюдения за работой системы – Монитор надежности и производительности (рис. 10.10). Для его запуска введите в строке поиска меню Пуск команду perfmon.msc, нажмите клавишу
10.10). Для его запуска введите в строке поиска меню Пуск команду perfmon.msc, нажмите клавишу
(3.10) Некоторые программы при старте или инсталяции жалуются, что DirectX 5.0 не установлен, хотя в W2k входит Directx 7.0.
(3.10) Некоторые программы при старте или инсталяции жалуются, что DirectX 5.0 не установлен, хотя в W2k входит Directx 7.0. Наличие DirectX 5.0 определяется несколько по-другому, чем наличие более поздних версий, поэтому некоторые старые програмы не находят DirectX вообще. Но их можно обмануть.
Сетевые средства
Сетевые средства
Комплексная автоматизацияВ сети Internet существует множество сервисов, предназначенных как для проверки web-сайтов, так и для их рекламирования различными методами.
Средства мониторинга
Средства мониторинга Планируется введение ряда так называемых виртуальных таблиц, которые будут предоставлять пользователю или администратору доступ к внутренней информации сервера (подобный подход использован в InterBase 7.0).Код. реализующий данные функциональные
Михаил Краснов Графика DirectX в Delphi
18.
 5.4. Средства преобразования
5.4. Средства преобразования
18.5.4. Средства преобразования Вторая крупнейшая проблема, связанная с DocBook, состоит в необходимости преобразования старой разметки уровня представления в разметку DocBook. Человек обычно может автоматически преобразовать представление документа в логическую структуру,
18.5.4. Средства преобразования
18.5.4. Средства преобразования Вторая крупнейшая проблема, связанная с DocBook, состоит в необходимости преобразования старой разметки уровня представления в разметку DocBook. Человек обычно может автоматически преобразовать представление документа в логическую структуру,
Средства конфигурации
Средства конфигурации
Компоновочные блоки можно инсталлировать как «приватные» или как «общедоступные».
Средства ClassView
Средства ClassView Конечно, вы можете продолжать набирать исходные тексты приложения вручную непосредственно в текстовом редакторе. Но во многих случаях среда VIsual C++ может оказать вам значительную помощь. Одним из средств, способных оказать вам такую помощь уже сейчас,
9.2 Средства
9.2 Средства Важно предусмотреть обеспечение задач документирования соответствующими и подходящими средствами.Инструментальные программные средства полезны для подготовки и контроля документации. Они могут быть применены для повышения эффективности многих процессов
1.
 7. DirectX 11
7. DirectX 11
1.7. DirectX 11 В Windows 7 самая последняя версия DirectX — 11. Это означает поддержку самых новых карт и новые возможности в играх. Вот только еще не все игры поддерживают DirectX 11. Одиннадцатая версия DirectX построена на базе десятой версии, но собрана на самом последнем «железе» —
Нейропыль как универсальный интерфейс «мозг — компьютер» и средство диагностики Андрей Васильков
Нейропыль как универсальный интерфейс «мозг — компьютер» и средство диагностики Андрей Васильков Опубликовано 18 июля 2013 Мишель Махарбиз, создатель первого в мире устройства для дистанционного управления насекомыми, разработал вместе с
Игра не запускается, требует обновления DirectX
Игра не запускается, требует обновления DirectX
DirectX – это библиотека для работы с графикой и звуком, разработанная компанией Microsoft, используется для создания игр и других программ, активно использующих графику.
Карманный знахарь: как быть с мобильными приложениями для быстрой (и неправильной) диагностики? Евгений Золотов
Карманный знахарь: как быть с мобильными приложениями для быстрой (и неправильной) диагностики? Евгений Золотов Опубликовано 20 марта 2013 Мобильные телефоны вобрали в себя множество функций, никогда с телефонами не ассоциировавшихся. Сегодня это и фотоаппарат, и
Технологии DirectX и VST
Технологии DirectX и VST
Произведенный компанией Microsoft программный интерфейс DirectX сделал возможным разработку программ для профессиональной (то есть производительной и эффективной) работы с графикой и звуком, в том числе и в реальном масштабе времени. Эта технология
Эта технология
Диагностика DirectX
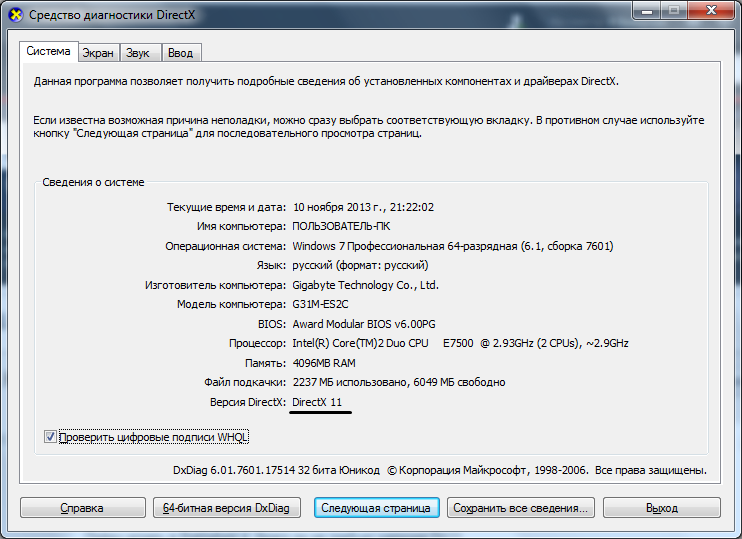
Еще одно замечательное средство диагностики работоспособности компьютера называется Средство диагностики DirectX. Данная программа отображает сведения о компонентах и драйверах интерфейса Microsoft DirectX. Программа позволяет проверить работу аудио- и видеокарты, а также установить связь с мультимедийными службами. С помощью средства диагностики также можно отключить некоторые средства аппаратного ускорения.
Зачем нужна эта диагностика? Это ваш первый друг, если не запускается свежеустановленная игра или в ее работе обнаружились какие-то проблемы, скажем, пропадает звук, глючит мышь, как-то неправильно отображаются текстуры, отсутствует или “глючит” доступ в сеть и т.д.
Интерфейс DirectX является интерфейсом прикладных программ (API), обеспечивающим совместимость между драйверами различных мультимедийных устройств. Кроме того, интерфейс автоматически определяет технические возможности аппаратных средств компьютера и настраивает их. Благодаря этому мультимедийные программы могут полноценно использовать все возможности аппаратных устройств компьютера. Интерфейс поддерживает драйверы современных видеокарт и аудиоплат, обеспечивает возможность обработки трехмерных объектов.
Кроме того, интерфейс автоматически определяет технические возможности аппаратных средств компьютера и настраивает их. Благодаря этому мультимедийные программы могут полноценно использовать все возможности аппаратных устройств компьютера. Интерфейс поддерживает драйверы современных видеокарт и аудиоплат, обеспечивает возможность обработки трехмерных объектов.
Чтобы запустить Средство диагностики DirectX, нажмите комбинацию клавиш <Win+R> и введите в поле запроса команду dxdiag.
В первую очередь на экране появится запрос, на который можно смело ответить “Да”. Затем появится основное окно программы.
Далее перечислены основные характеристики интерфейса DirectX и его компонентов.
- DirectDraw обеспечивает прямой доступ к видеоадаптеру ПК.
- Direct3D включает поддержку специализированных наборов процессорных команд, что обеспечивает дополнительное ускорение на новых моделях компьютеров, и предназначен для отображения трехмерной графики в режиме реального времени.

- DirectSound обеспечивает связь между программами и функциями микширования, записи и воспроизведения звука, поддерживаемыми аудиоадаптером.
- DirectMusic — интерактивный компонент, работающий с цифровыми аудиоданными, а также с управляемыми музыкальными данными.
- Directlnput обеспечивает быструю обработку сигналов устройств ввода.
- DirectPlay обеспечивает подключение к сетевым играм.
- DirectShow обеспечивает высококачественную запись и воспроизведение файлов мультимедиа, расположенных на локальном компьютере и интернет-серверах.
В диалоговом окне Средство диагностики DirectX размещены вкладки, благодаря которым можно отобразить сведения о системе (вкладка Система), ознакомиться со списком и расположением файлов DirectX в системе (вкладка Файлы DirectX), а также с параметрами устройств ввода, графической и аудиосистем, равно как сетевыми компонентами (группа Устройство вкладок).
При запуске диагностического средства DirectX выполняется автоматическое тестирование всех компонентов интерфейса.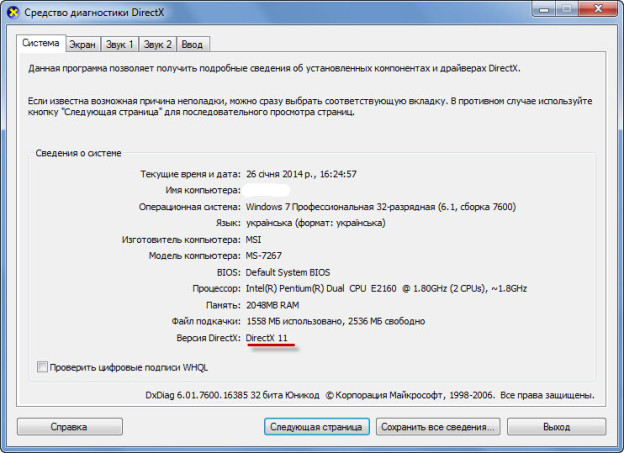 С отчетами проверок можно ознакомиться в поле Примечания, расположенном внизу каждой вкладки окна Средство диагностики DirectX.
С отчетами проверок можно ознакомиться в поле Примечания, расположенном внизу каждой вкладки окна Средство диагностики DirectX.
Теперь, начиная с первой вкладки Система, последовательно щелкайте на кнопке Следующая страница внизу окна, чтобы перейти от одной вкладки к другой и, тем самым, проверить, все ли в порядке. В поле Примечания каждого окна должна быть желанная фраза “Неполадок не найдено”.
Все проверки могут быть выполнены и вручную, для чего достаточно в поле Возможности каждой вкладки воспользоваться кнопками Проверка и ответить на вопросы в окнах сообщений, сопровождающих тестирование. В группе Возможности всех вкладок расположены кнопки для отключения функций DirectX, а также ползунок регулятора аппаратного ускорения аудиосистемы (вкладка Звук).
В общем и целом, все просто. Щелкайте на кнопка Проверка в нужных вкладках, и если неполадок не найдено – поздравляем, жизнь прекрасна ! Ну а если обнаружились какие кракозябры – статьи этом сайте помогут с ними справится 😉 (самостоятельно программа диагностики DirectX, увы, ничего не исправит, зато покажет, есть ли в работе некоторых компонентов системы те или иные проблемы).
Как узнать какой directx установлен
Многим пользователям, при установке программного обеспечения, требуется знать, какие драйвера уже установлены для этого или других приложений. Это требуется для того, чтобы не поставить старые дрова вместо новых. Как узнать, какой directx установлен, можно прочитать в данной статье.
Узнать о том, какая версия драйверов DirectX у вас установлена можно двумя способами, каждый из который по своему прост и удобен.
Первый способ узнать какой directx установлен
В винде присутствует средство, с помощью которого можно продиагностировать систему на наличие установленных компонентов DirectX и узнать, какая у них версия. Чтобы воспользоваться этой утилитой, необходимо сделать следующие действия:
- Заходим в Пуск – Выполнить, или если у вас 8/8.1, то Win+R.
- Вбиваем в строку поиска – dxdiag и подтверждаем выполнение.
- Соглашаемся на все всплывающее окно:
- После этого у вас появится на экране примерно такое окно:
- Как мы видим, последняя строчка укажет нам какая версия сейчас установлена на компьютере.
 У нас она 11, то есть, на данный момент, она самая новая.
У нас она 11, то есть, на данный момент, она самая новая. - Возможно у вас может стоять версия драйвера от 1.0 до 9.0. Особенностью этих версий является наличие цифрового кода, расшифровку которого вы можете получить из данных следующей таблицы:
Второй способ узнать какой directx установлен
В сети есть очень много программ, которые могут продиагностировать ваш компьютер, показать выкладку компонентов, проанализировать программное обеспечение, установленное у вас на ПК. В частности, для проверки версии directx, есть программа, которая распространяется на бесплатной основе – PC-Wizard. Скачайте и установите программу, а после запуска и сбора информации, выберите пункт «Конфигурация», а потом DirectX и вы увидите версию установленного драйвера. Рассмотрим пример с другого компьютера:
Похожие записи
Как узнать какой DirectX установлен на компьютере
DirectX – пакет библиотек, который позволяет отобразить на мониторе малейшие детали графики в приложениях.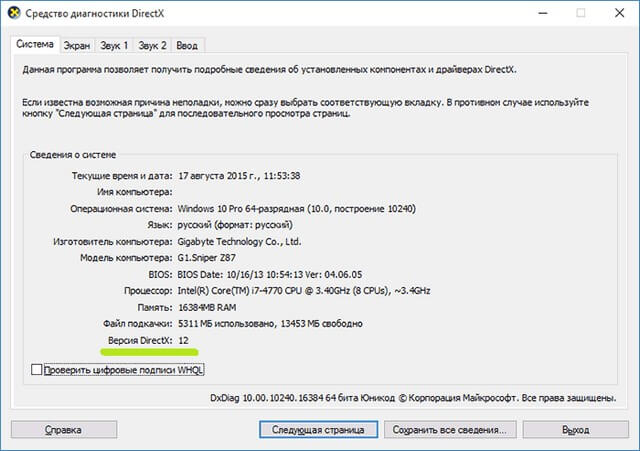 Для каждой версии Windows подходит своя версия…
Для каждой версии Windows подходит своя версия…
Как узнать версию directx
Мультимедийная технология DirectX используется на многих компьютерах, где установлена операционная система Windows. Чаще всего, эта версия позволяет проверить обновления на игры, которые адаптированы для ОС. Теперь вам достаточно узнать где…
Как удалить DirectX на Windows 7, 8|8.1, 10
Системные библиотеки DirectX разрабатываются для программирования из-под ОС и для совместимости приложений в этой же системе. Как говорят разработчики из Майкрософта, последние актуальные версии, перед запуском релиза определённой версии…
Как узнать какая версия DirectX установлена на компьютере
 Ошибочно считать, что это просто программа, которая нужна пользователям.
Ошибочно считать, что это просто программа, которая нужна пользователям.На деле DirectX представляет собой набор инструментов, который поддерживается компанией Microsoft для разработчиков. Программировать сложные приложения и игры для Windows невозможно без DirectX. Должен быть он установлен и на компьютере конечного пользователя разработанной программы или игры, чтобы Windows могла с ней взаимодействовать. Регулярно инструменты DirectX совершенствуются и выходят его новые версии. Именно поэтому пользователю важно знать, какой DirectX установлен на компьютере, и не требуется ли его обновить для работы с современной игрой.
Как узнать какой DirectX установлен
Определить версию DirectX на компьютере под управлением Windows очень просто, для этого необходимо:
- Нажать на клавиатуре комбинацию Windows+R, чтобы открыть строку «Выполнить»;
- В ней потребуется прописать команду dxdiag;
- После этого откроется окно со сведениями о системе, которое носит название «Средства диагностики DirectX».

Важно: На компьютер можно установить любую версию DirectX. Однако есть важный нюанс: если она не поддерживается аппаратно, то система Windows не сможет с ней работать. Тогда операционная система выбирает в качестве активной максимально старшую поддерживаемую версию DirectX, и именно она отображается в диагностическом меню, информация о котором приведена выше.
Как определить версию DirectX с помощью сторонних программ
Помимо встроенных в операционную систему утилит, определить версию DirectX на компьютере позволяют сторонние приложения. При этом они способны предоставить информации куда больше, чем команда dxdiag, о которой сказано выше.
Удобным средством диагностики компьютера является приложение AIDA64. Его бесплатную версию можно загрузить с официального сайта разработчиков. Данная программа позволяет узнать данные обо всех компонентах компьютера, а также о программной составляющей.
В левом меню приложения можно видеть отдельный пункт DirectX. В нем собрана информация в трех подразделах: файлы, видео, звук:
- «Файлы». В ней можно посмотреть все имеющиеся на компьютере файлы, относящиеся к DirectX. Это бывает полезно, например, в ситуации, когда необходимо удалить определенный файл из DirectX, когда с ним возникла ошибка. Также на вкладке можно посмотреть последнюю дату изменения файлов DirectX, узнать их вес и многие другие параметры;
- «Видео». Здесь выводится информация о видеокарте компьютера, а также об используемых ею драйверах. В пункте «Аппаратная поддержка» обозначена максимальная версия DirectX, которая поддерживается графическим ускорителем с текущей версией драйверов;
- «Звук». Информация о звуковых параметрах компьютера.
AIDA64 – это не единственная диагностическая программа для компьютера. В сети можно найти множество ее аналогов, как платных, так и бесплатных.
Почему не работает DirectX 12 на Windows 10
Одной из особенностей операционной системы Windows 10, которую активно продвигает компания Microsoft, являются игры.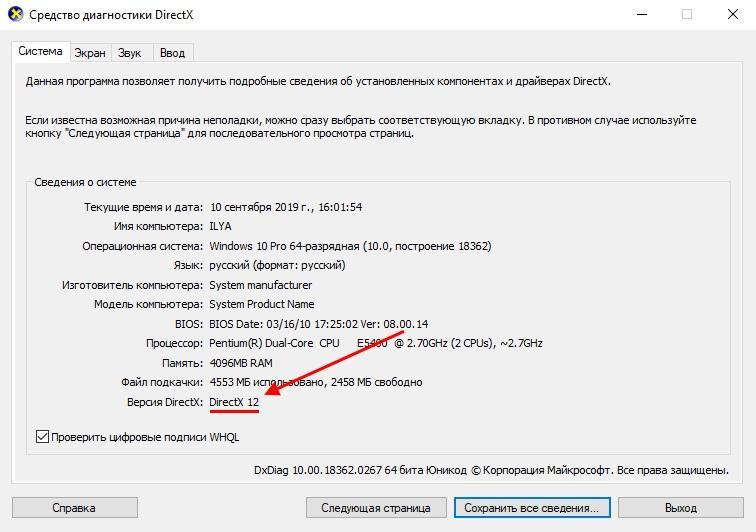 Новая версии операционной системы на «близком к железу уровне» работает с играми, которые разрабатываются на DirectX 12. Это позволяет игрокам на маломощных компьютерах запускать проекты, которые требуются высокой производительности.
Новая версии операционной системы на «близком к железу уровне» работает с играми, которые разрабатываются на DirectX 12. Это позволяет игрокам на маломощных компьютерах запускать проекты, которые требуются высокой производительности.
При этом некоторые пользователи Windows 10 могут обнаружить при проверке, что у них установлен DirectX 11 или 11.2, а не современный DirectX 12. В такой ситуации нет необходимости качать DirectX 12 с официального сайта Microsoft и устанавливать его на компьютер, поскольку это не поможет. Данная версия драйверов изначально имеется в Windows 10, и решение проблемы следует искать в другой плоскости.
Если вместо DirectX 12 на Windows 10 у вас отображается при проверке DirectX 11.2, это связано с:
- Устаревшей видеокартой, используемой в компьютере. Новые инструменты от компании Microsoft не поддерживаются старыми платами;
- Неактуальной версией драйверов для видеокарты. Чтобы проверить актуальность драйверов, зайдите на сайт разработчиков видеокарты и загрузите последнюю версию программного обеспечения для вашей модели графического ускорителя.
 Обратите внимание, если при установке драйвера будет возникать ошибка, необходимо предварительно удалить с компьютера старую версию ПО для видеокарты.
Обратите внимание, если при установке драйвера будет возникать ошибка, необходимо предварительно удалить с компьютера старую версию ПО для видеокарты.
Важно отметить, что более свежий DirectX на компьютере не заменяет предыдущие версии. То есть, если для запуска приложения или игры требуется DirectX 8,9 или 10, а на компьютере установлены более поздние версии, необходимо загрузить «старый» драйвер.
Загрузка…Как узнать версию DirectX и проверить в Windows
Операционная система Windows имеет настолько сложную структуру, что полностью разобраться в ней, пожалуй, могут только ее создатели. Windows состоит из множества компонентов, один из которых — DirectX. Он является набором библиотек, обеспечивающих правильную работу мультимедиа и игр.
DirectX устанавливается вместе с операционной системой, между тем он регулярно обновляется, одновременно новые игры требуют новые версии DirectX. По этой причине может появиться необходимость узнать установленную DirectX.
Версия DirectX в Windows 7
Есть простой способ, который позволяет узнать, какая версия DirectX установлена на компьютере. Необходимо нажать клавишу «Пуск» и выбрать пункт «Выполнить», где следует ввести «dxdiag» и нажать клавишу Enter.
После этого откроется окно со средствами диагностики DirectX. После первого запуска программа проверит цифровые подписи драйверов, что занимает менее одной минуты, а потом покажет сведения о системе. В последней строке — версия DirectX.
Если это не удалось сделать через команду «Выполнить», есть еще один способ. Необходимо открыть папку Windows, которая в большинстве случаев находится на диске С, а в ней — папку System32, найти там файл dxdiag.exe и запустить его.
Версия DirectX в Windows 10
Версия DirectX в Windows 10 проверяется точно так же, как и в 7, однако с этой операционной системой есть один нюанс. В «Средстве диагностики DirectX» в основной вкладке «Система» может отображаться одна версия.
А во вкладке «Экран» — другая версия DirectX.
В первом случае указывается установленная версия DirectX, а во втором — поддерживаемая Windows, видеокартой и драйверами к ней.
Проверка с помощью программ
Может случиться так, что команда dxdiag не выполняется. В этом случае можно использовать сторонние программы. Программ для определения версии DirectX существует огромное множество, среди которого можно выделить:
- GPU-Z, предоставляющая подробную информацию о графических возможностях системы;
- PC-Wizard — решение для комплексной диагностики установленного программного обеспечения;
- AIDA64 — утилита, отображающая данные обо всех компонентах системы.
На последней остановимся подробнее. AIDA64 – небольшая утилита, которая не требует установки. Пользоваться программой можно бесплатно на протяжении 30-ти дней. В главном меню программы следует выбрать пункт DirectX – видео.
После этого программа покажет не только версию DirectX, но и графические возможности системы.
AIDA64 показывает именно установленную версию DirectX, а не используемую. Также с ее помощью легко протестировать графические возможности компьютера и узнать, насколько можно разогнать видеокарту.
узнаем версию утилиты, установленной на вашем ПК
Активные юзеры, которые часто играют в различные игры сталкиваются с такой программой как DirectX. Если кто-то ещё не в курсе, что это такое и для чего он нужен, попробуем вкратце объяснить. Это, разработанный набор файлов программных библиотек для нормальной работы игр на компьютере. Проще сказать — это программа, без которой, игры не будут запускаться или попросту зависнут. В лучшем случае без Директ Икс, игры будут попросту тормозить, но это не доставит никакого удовольствия. Заядлые игроки знают, что почти с каждой игрой на диске обычно поставляется и актуальная версия DirectX, без которой данная игра попросту не будет работать. Естественно, при установке какой-нибудь игры нужно учитывать и наличие на компьютере поддерживаемого Директ Икс.
Как посмотреть версию DirectX
На самом деле узнать, какая версия библиотек API установлена в компьютере очень просто.
- В поисковой строке Виндовс пишем команду - dxdiag.
- Открываем утилиту.
Это маленькая утилита для диагностики DirectX и проверки версии .
В окне программы м ы можем посмотреть всю информацию о системе. Текущий установленный выпуск, файл подкачки, объём оперативной памяти, версию и разрядность системы, а также прошивки BIOS.
Как узнать Директ Икс на Виндовс 7
- Кроме того, есть ещё способ как узнать версию Директ Икс, для этого нужно запустить классическое приложение «Выполнить» .
- Сделать это можно несколькими способами. В Виндовс 7 оно находится в меню «Пуск ». Или использовать комбинацию клавиш WinKey+R (для любых операционных систем семейства Виндовс).
WinKey - это клавиша «домой» , обычно она отмечена логотипом Виндовс.
- В открывшемся окне приложения вписать команду для запуска диагностики Директ Икс.
Виндовс 10 проверка версии Директ Икс
А также узнать какой DirectX установлен в системе, можно через консоль командной строки. Запустить её можно множеством способов. В последних версиях Виндовс 10, к примеру, проще всего это сделать через кнопку «Пуск », на которой нужно выполнить правый клик, и в списке выбрать Windows PowerShell . Затем в консоли вписать нашу заветную команду для запуска утилиты диагностики Директ Икс.
Смотрим Директ Икс в Виндовс 8
Команду для запуска диагностики dxdiag в операционных системах Виндовс 8 можно открыть следующим способом:
- Переходим на стартовый экран, далее кликаем на стрелочку вниз, чтобы открыть список всех приложений, и здесь в строке поиска и пишем нашу команду.
Также можно проверить выпуск с помощью стороннего софта, например, с помощью программы AIDA64 или Everest. Обе программы от одного разработчика и практически идентичны. Из всех возможных функций и возможностей, которыми они обладают, там также можно посмотреть какая версия Директ Икс установлена на компьютере.
@
Мультимедийная технология DirectX используется на многих компьютерах, где установлена операционная система Windows. Чаще всего, эта версия позволяет проверить обновления на игры, которые адаптированы для ОС. Теперь вам достаточно узнать где посмотреть версию Directx и все игры на вашем компьютере будут исправно функционировать.
Проверка последней версии осуществляется при выполнении простейших программ, которые помогут решить вопрос как проверить версию Directx на Windows 10. Все операции осуществляются при помощи задания команды диагностики Directx.
- Нажимаем кнопку «Пуск», после этого вводим в пустое поле значение dxdiag , после чего подтверждаем свои действия, нажимая на клавишу «Ввод».
- В механизме диагностики переходим на вкладку «Система», тем самым вы можете узнать, как посмотреть версию Directx, используя данные номера в закладке «Сведения о системе».
В некоторых случаях, версия DirectX может быть ниже той, что предусмотрена для вашей игры. Как можно поступить в данном случае? Рассмотрим иной вариант обновления программы. Так мы узнаем, как проверить какая версия Directx установлена на вашем ПК.
Центр обновления Майкрософт предложит вам скачать обновлённый DirectX. Чаще всего система сама предлагает пользователю вариант скачивания программ или захода в электронную библиотеку, которая автоматически обновится до необходимой версии продукта.
После этого скачиваем программу dxwebsetup.exe на компьютер, версия должна быть как можно свежее.
После того, как установили программу, запускаем в работу помощника настройки, который обновит библиотеки до нужной версии.
Как узнать версию D irectx в W indows 10 для своего персонального компьютераНекоторые пользователи последней операционной системы Windows 10 ошибочно считают, что любая версия DirectX подойдёт для вашего ноутбука или ПК. В данном случае, посмотреть какая версия DirectX подойдёт для вашей операционной системы поможет небольшая справка данных:
- Windows XP, для этой ОС актуальным будет вариант DirectX 9;
- Windows 10, актуальой будет 12-я версия DirectX, но и нормально работает тоже 9, 10, 11;
- Windows Vista, также актуальной будет версия типа DirectX 10;
- Windows 7, используется версия серийного типа DirectX 11.
Как видно, для ряда операционных систем подходит одна и та же версия, для других ОС некоторые версии конфликтуют друг с другом.
Теперь остаётся узнать, как посмотреть версию Directx на Windows 10 для библиотеки поиска. Как правило, в конечном итоге подходит даже 12 версия, самая поздняя. На самом деле видеокарта в «десятой» операционной системе может без проблем поддерживать DirectX 9.1 версии, а также 10 или 11 версии.
Если у вас есть встроенная видеокарта, рекомендуется часто обновлять драйвера, в итоге вы можете узнать точную версию ДиректИкс для вашей ОС. Как показывает реальный опыт, если вы все правильно сделали, то работоспособность вашей видеокарты повышается на 10-15%. При помощи точно таких же операций можно проверить и устранить неполадки, которые имеет DirectX. Установка новой версии Директ Икс позволяет снова использовать игру и видео вашего персонального компьютера в полной мере по техническим параметрам эксплуатации.
Операционная система Windows имеет довольно сложную структуру, разобраться в которой под силу только ее разработчикам. Для грамотной работы всех ее компонентов в приложениях и играх, которые требуют серьезных ресурсов, разработчики из студии Microsoft выпускают специальный набор инструментов – DirectX. Ошибочно считать, что это просто программа, которая нужна пользователям.
На деле DirectX представляет собой набор инструментов, который поддерживается компанией Microsoft для разработчиков. Программировать сложные приложения и игры для Windows невозможно без DirectX. Должен быть он установлен и на компьютере конечного пользователя разработанной программы или игры, чтобы Windows могла с ней взаимодействовать. Регулярно инструменты DirectX совершенствуются и выходят его новые версии. Именно поэтому пользователю важно знать, какой DirectX установлен на компьютере, и не требуется ли его обновить для работы с современной игрой.
Как узнать какой DirectX установлен
Определить версию DirectX на компьютере под управлением Windows очень просто, для этого необходимо:
- Нажать на клавиатуре комбинацию Windows+R, чтобы открыть строку «Выполнить»;
- В ней потребуется прописать команду dxdiag;
- После этого откроется окно со сведениями о системе, которое носит название «Средства диагностики DirectX». На вкладке «Система» внизу можно увидеть графу, в которой указывается, какой DirectX установлен на компьютере.
Важно: На компьютер можно установить любую версию DirectX. Однако есть важный нюанс: если она не поддерживается аппаратно, то система Windows не сможет с ней работать. Тогда операционная система выбирает в качестве активной максимально старшую поддерживаемую версию DirectX, и именно она отображается в диагностическом меню, информация о котором приведена выше.
Как определить версию DirectX с помощью сторонних программ
Помимо встроенных в операционную систему утилит, определить версию DirectX на компьютере позволяют сторонние приложения. При этом они способны предоставить информации куда больше, чем команда dxdiag, о которой сказано выше.
Удобным средством диагностики компьютера является приложение AIDA64. Его бесплатную версию можно загрузить с официального сайта разработчиков. Данная программа позволяет узнать данные обо всех компонентах компьютера, а также о программной составляющей.
В левом меню приложения можно видеть отдельный пункт DirectX. В нем собрана информация в трех подразделах: файлы, видео, звук:
AIDA64 – это не единственная диагностическая программа для компьютера. В сети можно найти множество ее аналогов, как платных, так и бесплатных.
Почему не работает DirectX 12 на Windows 10
Одной из особенностей операционной системы Windows 10, которую активно продвигает компания Microsoft, являются игры. Новая версии операционной системы на «близком к железу уровне» работает с играми, которые разрабатываются на DirectX 12. Это позволяет игрокам на маломощных компьютерах запускать проекты, которые требуются высокой производительности.
При этом некоторые пользователи Windows 10 могут обнаружить при проверке, что у них установлен DirectX 11 или 11.2, а не современный DirectX 12. В такой ситуации нет необходимости качать DirectX 12 с официального сайта Microsoft и устанавливать его на компьютер, поскольку это не поможет. Данная версия драйверов изначально имеется в Windows 10, и решение проблемы следует искать в другой плоскости.
Если вместо DirectX 12 на Windows 10 у вас отображается при проверке DirectX 11.2, это связано с:
Важно отметить, что более свежий DirectX на компьютере не заменяет предыдущие версии. То есть, если для запуска приложения или игры требуется DirectX 8,9 или 10, а на компьютере установлены более поздние версии, необходимо загрузить «старый» драйвер.
В этой инструкции мы разберем вопрос, с которым сталкиваются некоторые пользователи: как узнать какой установлен DirectX на компьютере. Бывают ситуации, когда пользователю необходимо знать, какая версия DirectX используется в операционной системе Windows, установленной на компьютере.
DirectX — пакет средств разработки, набор API, решающий задачи по программированию в среде Microsoft Windows. Средства разработки DirectX наиболее часто используется при написании компьютерных игр под операционную систему Windows.
Помимо того, что DirectX встроен в операционную систему, Директ Икс часто поставляется вместе с компьютерными играми для установки на ПК вместе с играми. Наиболее последняя версия DirectX делает более совершенным отображение игровой графики на компьютере, позволяет раскрыть все возможности программного обеспечения.
На компьютере установлен DirectX, как узнать версию? Проверить версию DirectX можно средством системы или с помощью стороннего софта.
В общем случае, версии DirectX соответствуют следующим версиям операционной системы Windows:
- DirectX 9 — Windows XP SP2
- DirectX 10 — Windows Vista, Windows 7
- DirectX 11 — Windows 7, Windows 8, Windows 8.1, Windows 10
- DirectX 12 — Windows 10
Обратите внимание на следующее:
На ПК могут быть установлены разные версии DirectX. Следует обратить внимание на поддержку видеокартой определенной версии DirectX, потому что, если оборудование не поддерживает данную версию средств разработки, Windows не сможет работать с данной версией на компьютере. Операционная система самостоятельно выберет самую последнюю поддерживаемую версию DirectX на компьютере.
Некоторые приложения требуют определенную версию DirectX на компьютере, поэтому пользователю придется самостоятельно скачать DirectX для установки на ПК.
В статье мы рассмотрим 4 способа получения информации об установленной версии DirectX: с помощью системного средства DxDiag, программного обеспечения видеокарты, при помощи сторонних программ (GPU-Z, AIDA64).
Как посмотреть какой DirectX установлен на компьютере средством системы DxDiag
Узнать версию DirectX можно с помощью утилиты DxDiag (DirectX Diagnostic Tool), встроенной в операционную систему Windows. Средство предоставляет подробную информацию, которая может понадобиться для устранения проблем с видео и звуком на компьютере.
Для запуска выполните следующие действия:
- Нажмите на клавиши клавиатуры «Win» + «R».
- В окне «Выполнить» введите команду «dxdiag» (без кавычек), а затем нажмите на кнопку «ОК».
В окне «Средство диагностики DirectX», во вкладке «Система», в разделе «Сведения о системе» напротив пункта «Версия DirectX» отобразится установленная версия DirectX.
В последних версиях Windows 10 DirectX всегда отображается в 12 редакции. На самом деле, оборудование компьютера может не поддерживать данную версию DirectX 12, поэтому я рекомендую посмотреть дополнительные сведения.
Откройте вкладку «Экран», в разделе «Драйверы» вы увидите уровни поддержки функций видеокарты, установленной на компьютере.
Как проверить какой DirectX на компьютере с помощью панели управления видеокарты
Узнать версию DirectX можно с помощью программного обеспечения видеокарты. Я покажу, как это сделать на примере видеокарты производства NVIDIA:
- Запустите «Панель управления NVIDIA».
- В левой колонке, в самой нижней части нажмите на ссылку «Информация о системе».
- В окне «Информация о системе», во вкладке «Дисплей» отобразятся данные о видеоплате.
На этом изображении видно, что в операционной системе версия среды выполнения DirectX 12, версия API Direct3D — 12, уровень возможностей Direct3D — 11. Это означает, что несмотря на поддержку системой новой версии DirectX 12, устаревшая видеокарта сможет полноценно работать только с DirectX 11.
Как узнать какой стоит DirectX в GPU-Z
Бесплатная программа GPU-Z предоставляет подробную информацию о графическом оборудовании, установленном на компьютере. Программа не требует установки на компьютер.
Выполните следующие шаги:
- Запустите программу GPU-Z на компьютере.
- Откройте вкладку «Advanced», на панели выберите «DirectX» (здесь могут быть разные версии Директ Икс), ознакомьтесь с предоставленной информацией.
Получение информации о DirectX в AIDA64
Программа выдает обширную информацию об оборудовании и программном обеспечении компьютера. В том числе, в AIDA64 вы можете посмотреть версию DirectX своего компьютера.
Пройдите шаги:
- Откройте программу AIDA.
- Во вкладке «Меню», в разделе «Компьютер» откройте «Суммарная информация». Здесь отобразится установленная версия DirectX (на моем компьютере — DirectX 12).
Для получения информации о поддерживаемой версии DirectX, откройте раздел «DirectX», а затем «DirectX – видео».
В разделе «Свойства Direct3D», напротив пункта «Аппаратная поддержка DirectX», вы увидите поддерживаемую версию DirectX (в моем случае — DirectX 11). Это значит, что видеокарта поддерживает 11 версию DirectX.
Выводы статьи
В случае необходимости, пользователь может узнать версию DirectX, установленную на компьютере в операционной системе Windows. Получить нужную информацию о Директ Икс можно с помощью средства DxDiag, программного обеспечения графической карты, и сторонних программ: GPU-Z, AIDA64.
Любой человек, играющий в игры на компьютере или даже использующий последний для решения повседневных задач, с большой долей вероятности встречался с такой вещью как DirectX, но далеко не каждый знает, что это такое, обязательно ли наличие этого компонента, зачем его необходимо обновлять и где скачать Microsoft DirectX 12 для Windows 10 бесплатно?
Что такое DirectX?
Объяснения сложным техническим языком в данном случае неуместны, подобную информацию всегда легко найти на официальных сайтах или же в Википедии. Простыми словами – это библиотека или набор инструкций, которые отвечают за взаимодействие аппаратных комплектующих компьютера и программного обеспечения. DirectX задействует, в основном, видеокарту, но не оставляет без внимания и знает, как открыть другие составляющие ПК, чтобы максимально направить их мощность на то, чтобы воспроизвести или в реальном времени создать элементы игры, заранее написанные разработчиками. Он работает автоматически, поэтому вас не должен волновать вопрос, как включить DirectX 12 на Windows 10. И, да, это не только средство воспроизведения, используемое игроками или обычными пользователями компьютера, но и инструмент для разработчиков, отталкиваясь от которого они находят максимальный уровень взаимодействия между аппаратной и программной составляющими. Тем не менее, вопрос, как переустановить DirectX на Windows 10 x64 или, вообще, нужно ли устанавливать — возникает особенно часто среди первых.
Этот набор библиотек был разработан компанией Microsoft и используется исключительно в операционных системах Windows.
Для чего нужен DirectX?
Следует отметить, что, если вы все-таки ни разу не сталкивались с таким понятием и можете ручаться за то, что не устанавливали ничего подобного в систему, компонент все равно присутствует, и есть даже способ, как посмотреть версию DirectX на Windows 10. Несмотря на то, что он направлен на игровые проекты, используется и при прочих процессах ОС, поэтому необходим, и устанавливается вместе с ней. В зависимости от версии Windows варьируется и версия библиотек – от 9.0 в Windows XP до 12.0 в Виндовс 10. И так далее, когда выйдет новая ОС – будет и новое обновление библиотек. Опять, же, это очень важный показатель. Каждая новая версия набора не просто подстраивается под новую операционную систему, но и предоставляет расширенные возможности для разработчиков, поэтому, теоретически, одинаковая игра, запущенная с 9 и 11 версией, может выглядеть очень по-разному – особенно, что касается визуальных эффектов. Именно поэтому важно знать, как установить DirectX 12 на Windows 10.
Важно! Сам набор никак не повлияет на качество, но количество технологий, доступных в разных версиях может значительно повлиять на то, как ими воспользуется разработчик, и что в итоге получится из игры. Отталкиваясь от этого, можно понять, .
Как узнать версию DirectX в Windows 10?
Проверка текущей версии, установленной в системе, не составит труда даже для начинающих пользователей.
Простейший способ, как проверить версию DirectX на Windows 10.
Благо, эти библиотеки – такой компонент, который легко найти и установить. Он бесплатен и всегда таковым был. Однако, в этом же скрывается очередная сложность, особенно для неопытных пользователей. Велика вероятность получения вредоносного файла. Но, опять же, существует простой, но надежный способ, как избежать всех возможных проблем – скачивать установочные файлы исключительно с официального сайта.
Скачать и установить набор библиотек
В данном случае, это официальный сайт Microsoft . Найти кнопку «Скачать» или «Download» на сайте.
Дальше жмем «Отказаться и продолжить».
Скачиваем файл dxwebsetup.exe, затем запускаем его.
Рекомендуется, как во время скачивания, так и при установке, обращать внимания на все этапы установочного процесса и на возникающие диалоговые окна, во время которых компания попытается поставить вам несколько своих продуктов – от Microsoft Office до панели Bing. Это, конечно, не вредоносные файлы, но, если вы в них не нуждаетесь, могут быть абсолютно бесполезны.
Соглашаемся с условиями лицензионного соглашения.
Затем их установка.
После установки нажимаем «Готово».
На сайте делается акцент на том, что этот компонент невозможно удалить, поэтому желательно создать точку , чтобы в случае каких-либо неполадок беспрепятственно восстановить ее с нужного места, таким образом избежав необходимости переустанавливать целиком. При установке не предлагается никаких возможностей, и вы не знаете, где находится DirectX в Windows 10. Даже путь выбирается автоматически, поэтому в процессе не должно возникнуть трудностей.
Как обновить версию DirectX 12 для Windows 10?
Важно знать, как обновить версию DirectX 12 для Windows 10 для 64 bit или 32 bit — скачивая установочный файл с сайта Microsoft, вы получаете не дистрибутив конкретной библиотеки, а скорее ассистент, который сперва определит версию вашей видеокарты и операционную систему, а затем, основываясь на этом, скачает нужные файлы для установки. Поэтому, фактически, устанавливая библиотеки таким способом, вы обновляете набор библиотек до последней версии. Вручную это не регулируется, а отталкивается от определенных факторов.
В редких случаях набор не обновляется. Это решается простой переустановкой.
Это единственный ответ на вопрос, почему не устанавливается DirectX 12 на Windows 10.
А если я не доверяю Microsoft?
Если вы не доверяете Microsoft, и хотите самостоятельно узнать, какую версию поддерживает ваша видеокарта, то вы можете сделать несколько вещей:
- Посетить официальный сайт производителя и найти соответствующую таблицу. Это насущный вопрос, поэтому проблем с поиском не должно возникнуть;
- Воспользоваться любой программой, определяющей набор компонентов ПК. В качестве одного из вариантов можно предложить бесплатную GPU-Z . Нужная информация находится в разделе «Graphics Card» в поле «DirectX Support».
Как проверить версию директ икс. Как узнать какой DirectX установлен на компьютере? Разные Windows и версии DirectX
Для Windows необходимо для запуска многих программ и практически всех компьютерных игр. И некоторые пользователи время от времени путаются с ее установкой. Отсюда возникает вопрос: «Как узнать, какой стоит DirectX?» . Именно его мы и осветим в этом материале.
Узнать, какая именно редакция ДиректХ присутствует в операционной системе, можно несколькими способами. Один из них основан на встроенной в Windows утилите, а второй предполагает использование стороннего программного обеспечения. Мы рассмотрим оба. Начнем по порядку.
Вариант №1: Использование системных возможностей
Итак, сначала поговорим о том, как проверить версию библиотек при помощи инструментов операционной системы. В частности, речь пойдет о встроенной утилите «Средство диагностики dxdiag». Вызвать ее получится с помощью диалогового окна «Выполнить». А делается это в несколько простых шагов:
Как видите, все предельно просто. Для того чтобы узнать тип установленных библиотек при помощи инструментов Windows, не требуется никаких специальных знаний. Все делается в пару кликов. Никаких проблем не возникнет даже у новичков.
Вариант №2: Стороннее ПО
Существует чрезвычайно полезная утилита AIDA64, предназначенная для аппаратной диагностики ПК. Она также может провести стресс-тест, составить отчет и сделать еще много чего. Бесплатной версии вполне хватит для того, чтобы просмотреть версию DirectX. Но для начала нужно скачать программу с официального сайта разработчика и инсталлировать ее. Разберем весь процесс поэтапно:
Заключение
В данном материале мы поговорили о том, как проверить, какой DirectX на компьютере. Первый способ связан с использованием встроенных инструментов операционной системы, он же является самым удобным. Но в некоторых случаях поможет сторонняя утилита для просмотра диагностических данных. Отлично под эти цели подходит AIDA64.
Вначале, давайте определимся, что собой представляет DirectX. Это пакет мультимедийных технологий, необходимых для того, чтобы на компьютере или ноутбуке запускались мультимедийные приложения, а также игры.
Часто, чтобы запускалась какая-нибудь игра, необходимо проводить обновление версии директа.
В большинстве случаев, многие игрушки, установленные на современном устройстве, сопровождаются актуальным пакетом директ, но если она не была обнаружена, то значит, необходимо самостоятельно посмотреть, какая последняя версия была установлена на операционной системе.
Обновление пакета помогает добиться лучшей графики в компьютерных играх, при условии, если на ПК была установлена мощная видеокарта.
То есть, к примеру, игра требует девятую DirectX, а человек установит 10-ую версию, и при этом, видеокарта будет слабая, значимых изменений, увидеть не получится.
Приведенная ниже инструкция для проверки установленной версии DirectX, будет действовать для операционной системы Windows 7.
Использование средства диагностики DirectX
Для начала необходимо нажать на кнопку «Пуск», в нижнем левом углу экрана, и там, в поле «Найти файлы и программы», вбить такой запрос, как dxdiag.
После того, как команда была введена, на клавиатуре необходимо нажать на клавишу «Enter».
Дальше будет открыто специальное окно, в котором человек, без труда во вкладке «Система», сможет увидеть установленную версию DirectX на ПК.
Применение вспомогательного софта
Не всем людям подходят традиционные методы проверки, некоторые любят убеждаться в результате, с помощью специальных утилит. И по этой причине, часто для проверки версии DirectX подходит такая программа, как Astra32.
Этот софт распространяется на бесплатной основе, и на официальном ресурсе, имеется возможность скачать Portable (версия, не требующая установку). После запуска этого софта на своем компьютере, начинается сканирование системы. После того, как сканирование подходит к концу, на главном экране, в самом первом окне, можно узнать установленную DirectX на своем ПК.
Сканирование занимает около минуты, и результат будет выведен в главном окне.
Бывают случаи, когда людям необходим не просмотр установленной версии, а полностью удаление директа со своего ПК.
Полностью удалить этот компонент со своего компьютера можно, с помощью таких актуальных программ, как «DirectX Killer» либо «DirectX Happy Uninstall». Названные утилиты не обладают большим функционалом, но они справляются с главной задачей на все сто процентов.
Теперь, не нужно долго разбираться в том, по какой причине может не запуститься купленная игра с системной ошибкой, достаточно ознакомиться с информацией, представленной в этой статье, чтобы узнать о необходимости использования директа.
Теперь, любой человек может узнать, как правильно проверять, какой директ установлен на рабочем ПК. Помимо операционной системы Windows 7, можно легко узнать директ икс и на других версиях Windows (XP, 10, и так далее).
Приветствую всех посетителей моего блога. Исторически так сложилось, что я сразу уловил связть между отсутствием dll файлов в системе и версией DirectX. Поэтому если при запуске игры вы вместо самой игрушки видите что-то вроде «Запуск программы невозможен, так как на компьютере отсутствует d3dx9_31.dll», то с вероятностью в 99% можно утверждать, что нужно обновить библиотеки DirectX.
С переходом на новые ОС от Windows обычные пользователи стали путаться в версиях Директ Икс. Многие ошибочно полагают, что установив например 9.0с на DirectX 11 — они удалят последнюю. Сразу вам скажу — он никуда не денется, просто дополнится библиотеками из 9.0 (хотя все нужные уже включены в последние версии, исключениями бывают некоторые игрушки)
Если вы ищете данную информацию, потому что не знаете что, можно с официального сайта, то эта заметка как раз для вас — тут мы все и рассмотрим! В сети полно ресурсов, которые предлагают скачать этот файл. Не ведитесь на это — как правило с таких сайтов очень просто словить вирус (а яндекс далеко не всегда помечает такие ресурсы как опасные)
Узнать это совсем просто, однако Microsoft мудрит с интерфейсом и в разных Windows это может выглядеть по разному, но логика не меняется от версии к версии. Итак, для Windows 7 кликаем «Пуск» и находим окошко поиска
Вводим в строке поиска и жмем Enter
Однако это подойдет только для Windows 7 и Windows Vista
Во всех версиях Windows без исключения можно вызвать команду выполнить и ввести там В этом случает запустится утилита DirectX. Если вы не знаете где у вас команда «Выполнить», то прочтите эту статью http://www.сайт/pc/setup_win/gde-v-puske-vypolnit/
И тут уже в «Средстве диагностики DirectX» мы и можем посмотреть версию.
Итак, мы узнали какой DirectX установлен, что же делать дальше? Конечно же обновлять!
Как обновить DirectX до последней версии?
Никогда, слышите? НИКОГДА не скачивайте DirectX с неизвестных сайтов. Скачать официальную и последнюю версию (точнее веб установщик) можно с официального сайта Майкрософт.
http://www.microsoft.com/ru-ru/download/details.aspx?id=35
Но я не люблю гонять своих посетителей по другим сайтам, поэтому залил себе на блог, можете скачать у меня
После того,как скачали — запускаем. Открывается «Установка Microsoft(R) DirectX(R)». Соглашаемся с лицензионным соглашением и жмем «Далее»
Нам предложат бесплатно установить панель Bing, но нам она ни к чему, поэтому убираем галочку напротив этого пункта.
Программа установки определит сколько еще компонентов нужно докачать (мне например 48,9 мегабайт), если все устраивает, жмем «Далее»
Ожидаем пока все скачается и установится (зависит от скорости вашего интернет-соединения)
Все, установка DirectX завершена.
Теперь вы знаете не только как узнать какой DirectX установлен, но и как его обновить. На самом деле если у Вас не Windows XP, то задумываться о версии нет особого смысла, нужно только обновить его до последней версии и никаких проблем с отсутствующими файлами быть не должно.
Вконтакте
DirectX – набор средств программирования для Windows, который, в большинстве случаев, используется при создании игр и другого мультимедийного контента. Для полноценной работы приложений, использующих библиотеки DirectX, необходимо иметь последние в составе операционной системы. В основном, вышеуказанный пакет устанавливается автоматически, при развертывании Windows.
Все игры, предназначенные для запуска под Windows, требуют обязательного наличия DirectX определенной версии. На момент написания статьи последней редакцией является 12. Версии являются обратно совместимыми, то есть игрушки, написанные под DirectX 11, запустятся и на двенадцатом. Исключения составляют только очень старые проекты, работающие под 5, 6, 7 или 8 директом. В таких случаях вместе с игрой поставляется и необходимый пакет.
Для того, чтобы узнать версию DirectX, которая установлена на компьютере, можно воспользоваться способами, приведенными ниже.
Способ 1: программы
Программное обеспечение, которое предоставляет нам информацию о системе в целом или о некоторых устройствах, может отображать и версию пакета DirectX.
Способ 2: Windows
Если нет желания устанавливать на компьютер специализированный софт, то есть возможность воспользоваться встроенным в систему «Средством диагностики DirectX» .
Активные юзеры, которые часто играют в различные игры сталкиваются с такой программой как DirectX. Если кто-то ещё не в курсе, что это такое и для чего он нужен, попробуем вкратце объяснить. Это, разработанный набор файлов программных библиотек для нормальной работы игр на компьютере. Проще сказать — это программа, без которой, игры не будут запускаться или попросту зависнут. В лучшем случае без Директ Икс, игры будут попросту тормозить, но это не доставит никакого удовольствия. Заядлые игроки знают, что почти с каждой игрой на диске обычно поставляется и актуальная версия DirectX, без которой данная игра попросту не будет работать. Естественно, при установке какой-нибудь игры нужно учитывать и наличие на компьютере поддерживаемого Директ Икс.
Как посмотреть версию DirectX
На самом деле узнать, какая версия библиотек API установлена в компьютере очень просто.
- В поисковой строке Виндовс пишем команду - dxdiag.
- Открываем утилиту.
Это маленькая утилита для диагностики DirectX и проверки версии .
В окне программы м ы можем посмотреть всю информацию о системе. Текущий установленный выпуск, файл подкачки, объём оперативной памяти, версию и разрядность системы, а также прошивки BIOS.
Как узнать Директ Икс на Виндовс 7
- Кроме того, есть ещё способ как узнать версию Директ Икс, для этого нужно запустить классическое приложение «Выполнить» .
- Сделать это можно несколькими способами. В Виндовс 7 оно находится в меню «Пуск ». Или использовать комбинацию клавиш WinKey+R (для любых операционных систем семейства Виндовс).
WinKey - это клавиша «домой» , обычно она отмечена логотипом Виндовс.
- В открывшемся окне приложения вписать команду для запуска диагностики Директ Икс.
Виндовс 10 проверка версии Директ Икс
А также узнать какой DirectX установлен в системе, можно через консоль командной строки. Запустить её можно множеством способов. В последних версиях Виндовс 10, к примеру, проще всего это сделать через кнопку «Пуск », на которой нужно выполнить правый клик, и в списке выбрать Windows PowerShell . Затем в консоли вписать нашу заветную команду для запуска утилиты диагностики Директ Икс.
Смотрим Директ Икс в Виндовс 8
Команду для запуска диагностики dxdiag в операционных системах Виндовс 8 можно открыть следующим способом:
- Переходим на стартовый экран, далее кликаем на стрелочку вниз, чтобы открыть список всех приложений, и здесь в строке поиска и пишем нашу команду.
Также можно проверить выпуск с помощью стороннего софта, например, с помощью программы AIDA64 или Everest. Обе программы от одного разработчика и практически идентичны. Из всех возможных функций и возможностей, которыми они обладают, там также можно посмотреть какая версия Директ Икс установлена на компьютере.
@
Ссылки по теме Войо Деретич, факультет Стр. Центр аутофагии, воспаления и метаболизма (AIM) События AIM и твиты AIM (@AIM_Tweets) Узнать больше об Autophagy Календарь событий аутофагии Пептиды, индуцирующие аутофагию Все интервью с преподавателями | Я Войо Деретич, и поэтому я занимаюсь исследованиями.Войо Деретич — профессор и заведующий кафедрой молекулярной генетики и микробиологии медицинского факультета Университета Нью-Мексико. Он также является директором Центра аутофагии, воспаления и метаболизма (AIM), финансируемого NIH и посвященного продвижению исследований аутофагии, в первую очередь поддерживая младший преподавательский состав в этой области исследований. Его работа по аутофагии продемонстрировала роль этого процесса рециклинга клеток в иммунитете через удаление инфекционных микроорганизмов и воздействие на воспаление.Его текущая работа сосредоточена на понимании сигнальных механизмов, которые активируют аутофагию и подчеркивают клеточный ответ на изменения целостности мембраны. Не могли бы вы рассказать нам, что вызвало у вас интерес к фундаментальной науке? Конечно, мой школьный проект был посвящен алкоголю. Но это не то, о чем вы сейчас думаете … Изучая эту тему, я был очарован возможностью предсказывать физико-химические свойства спиртов, такие как точки кипения и плавления, в зависимости от длины алифатических цепей и даже от их значений.нечетное количество атомов углерода, насыщенные и ненасыщенные и т. д. С тех пор для меня все было связано с движущимися молекулами. Вы сделали много важных открытий в процессе селективной аутофагии. Есть ли один конкретный эксперимент или открытие, которым вы больше всего гордитесь? «Ага момент»? Да, часто, но особенно когда мы думали, что, возможно, только возможно, аутофагия может захватить вторгшиеся микробы и убить их. Именно это многие считают нашей знаковой статьей в Cell в 2004 году.Тогда это было очень ясно и просто, и это был такой «момент ага». Последнее было в 2018 году (исследование было опубликовано в Molecular Cell несколько месяцев назад), когда мы обнаружили, что лизосомное повреждение контролирует активность mTOR и AMPK через галектины, распознающие мембранные разрывы, и что эта передача сигналов затем активирует аутофагию, а также метаболически перепрограммирует клетку. . По-прежнему перебираю красоту этого «ага-момента», потому что он тоже прост и я считаю красивым.
Расскажите подробнее о вопросах, на которые вы и ваша лаборатория в настоящее время пытаетесь ответить, и о том, в чем, по вашему мнению, будут развиваться ваши исследования в будущем. Прямо сейчас мы очарованы сигнализацией, управляющей AMPK и mTOR. Я думаю, что регулирование этих систем непосредственно наверху связано с целостностью мембраны, т.е.е. не только питательный и энергетический статус. Не могли бы вы подробнее рассказать о важности вашего исследования для обычного гражданина. Деградация против биогенеза — это инь и ян жизни. Мы, так сказать, застряли в своем теле, и ключевой вопрос заключается в том, как удалить и заменить старые, больше не функционирующие части изнутри. Знание того, как это сделать, может хранить секреты долголетия, качества жизни, профилактики и лечения заболеваний с головы до пят. Мы надеемся, что вскоре (а не когда-нибудь) это исследование сделает нас более здоровыми и счастливыми.Кроме того, мы стремимся к таким большим заболеваниям, как болезнь Альцгеймера, Паркинсона, диабет, рак, с одной стороны, и туберкулез, ВИЧ и всевозможные воспалительные заболевания, с другой. В этом прелесть аутофагии как мишени для наркотиков. Лабораторное фото с весенних АТГ 2018 (традиционные сборы аутофагии). Слева направо: Суреш Кумар, Сон Вон Чой, Юэси Гу, Аврора Клод-Таупен, Джин Юэ Цзя, Ли Аллерс, Бхавана Бисса, Михал Мадд. Ваше исследование расширило наше понимание связи между галектинами и аутофагией в эндомембранном гомеостазе.Есть ли один эксперимент или открытие, которым вы больше всего гордитесь? Я думаю, что самым полезным моментом было то, что мы подвергли наше исследование, о котором вы говорите, окончательной проверке объективного анализа постфактум. Пока статья находилась на пересмотре, мы провели протеомный анализ BioID с динамической ЖХ-МС / МС в клетках, подвергшихся повреждению мембраны, и, к моему большому удивлению, все компоненты системы галектина 8-mTOR и их поведение были полностью проверены. Еще более удивительным и парадоксально удовлетворяющим было то, что мы не нашли никаких новых компонентов (что, откровенно говоря, я полностью ожидал) по сравнению с тем, что мы уже обнаружили.В общем, это показало нам, что мы не упустили чего-то потенциально более важного. Интересный поворот — поскольку протеомные исследования часто приводят к исследованию, в данном случае это была скорее проверка постфактум. Я все еще восхищаюсь своей реакцией на результаты массовых спецификаций с чувством подтверждения, а не разочарованием из-за того, что не нашел дополнительных компонентов. Ваши открытия расширяют значение галектинов в аутофагии до гораздо большего, чем просто «метки», предупреждающие о повреждении мембраны.Какие последствия вы предвидите для стратегий, направленных на борьбу с такими заболеваниями, как рак? Раковые клетки превышают разрешенные пределы, и это, по сути, определение рака. Два регулятора аутофагии, mTOR и AMPK, которые, как мы теперь знаем, контролируются галектинами в ответ на повреждение эндомембраны, также являются ключевыми регуляторами общего метаболизма, лежащего в основе способности роста и распространения. Раковые клетки зависят от измененной регуляции или, скорее, от нарушения регуляции mTOR и AMPK.Мы думаем, что связь между повреждением эндомембраны и клеточным метаболизмом в целом является новой, неизученной областью, и мы надеемся, что она вооружит нас новыми подходами к терапии рака. Представьте себе способность препятствовать росту раковых клеток, повреждая лизосомные мембраны. Расскажите, почему вы исследуете? Что мотивирует вас продолжать идти вперед? По сей день я остаюсь любопытным ребенком. Возможно, это незрелое состояние, но я полностью его принимаю и получаю от него удовольствие. Острые ощущения от открытия не похожи ни на какие другие.Это помогает мне справляться с более приземленными и иногда утомительными аспектами исследования. В общем, исследования — это сложно, но интеллектуальное вознаграждение трудно превзойти. Иногда исследования похожи на искусство, и я часто думаю о художниках и их трудностях. Какой совет вы дали бы начинающим ученым, заинтересованным в продолжении работы? Наука — это не просто еще одна работа. Это привилегия. Мы часто жалуемся на трудности, но раньше исследования оставались зарезервированными для независимо богатых людей, которые могли финансировать занятия своим интеллектуальным любопытством, или для тех немногих, кого поддерживали богатые.Современные общества позволяют нам, получив соответствующее образование и подготовку, достичь этого положения более демократичным способом. Наслаждайтесь возможностями и считайте себя привилегированными. Еще один момент — не беспокоиться о том, что там очень высокая конкуренция. Радуйтесь тому, что вокруг много-много умных людей, каждый из которых нам нужен по разным научным и политическим причинам. Рассматривайте свою карьеру в науке не только как возможность, но и как свой общественный долг. И, наконец, если бы вы могли встретить любого ученого из прошлого, с кем бы вы встретились и почему? Ой, это захватывающий вопрос, но я лучше буду осторожен…, Не могли бы вы договориться о встрече с Альфредом Уоллесом, менее известным современником Дарвина с такими же идеями.Я люблю подводное плавание с аквалангом, и Уоллес — мой герой, признавший разнообразие морской жизни и определивший биоклин в Индонезии. Пока вы занимаетесь этим, позвольте мне познакомиться с Аристотелем, Имхотепом, Галилеем, Ньютоном, Бернулли, Больцманом, Максвеллом, Полингом (я встречался с Криком) и Мари Кюри, и … Вернуться в архив интервью с преподавателями |
Секреторная и деградационная аутофагия: нетрадиционная секреция медиаторов воспаления — FullText — Journal of Natural Immunity 2013, Vol.5, № 5
Абстрактные
Аутофагия (макроаутофагия) часто определяется как деградационный процесс, являющийся частью лизосомного пути. В этом контексте аутофагия осуществляет контроль качества цитоплазмы и функции питания, удаляя несуществующие или вышедшие из употребления органеллы, частицы-мишени и вторгшиеся микробы, а также путем переваривания цитоплазмы. Однако недавние исследования показывают, что аутофагия неожиданно влияет на несколько секреторных путей.Аутофагия участвует во внеклеточной доставке ряда цитозольных белков, которые не входят в обычный секреторный путь через аппарат Гольджи, а вместо этого секретируются нетрадиционным образом непосредственно из цитозоля. В клетках млекопитающих прототипическим примером этого проявления аутофагии является нетрадиционная секреция главного провоспалительного цитокина, IL-1β. В этом обзоре исследуется концепция секреторной аутофагии, а также сравнивается и противопоставляется роль аутофагии в секреции IL-1α и IL-1β.Хотя IL-1α и IL-1β имеют тесно связанные внеклеточные воспалительные функции, они различаются внутриклеточной активацией, секреторными механизмами и тем, как на них влияет аутофагия. Этот пример показывает, что роль аутофагии в секреции более сложна, по крайней мере, в клетках млекопитающих, чем упрощенное представление о том, что аутофагосомы обеспечивают носителей для нетрадиционной секреции цитозольных белков.
© 2013 S. Karger AG, Базель
Введение: Секреторная аутофагия
В нашем нынешнем взгляде на секрецию белка эукариотическими клетками доминирует устоявшаяся классическая парадигма традиционной секреции (рис.1, справа). Эта парадигма основана на широко охарактеризованном пути биосинтеза, используемом белками, наделенными сигналами сортировки (лидерные пептиды), позволяющими им проникать в просвет эндоплазматического ретикулума (ER). Оттуда они претерпевают модификации и переносятся через аппарат Гольджи (G) и, наконец, секретируются при слиянии пост-Гольджи-носителей с плазматической мембраной (PM). Новая парадигма секреции белка была недавно определена у дрожжей [1,2,3] как нетрадиционная секреция, основанная на аутофагии, в эукариотических клетках.В принципе, это явление (секреторная аутофагия; рис. 1, слева) может позволить любому цитозольному белку экспортироваться из клетки, где он может выполнять свою основную или скрытую биологическую функцию. Прямая функция аутофагии в нетрадиционной секреции путем предоставления носителей для секреции (рис. 1, слева) была описана у дрожжей с использованием комбинации генетических и клеточных биологических инструментов [1,2,3]. Секреторная аутофагия также задействована в клетках млекопитающих [4,5,6]. В настоящее время существует два основных признака, определяющих секреторную аутофагию: (1) участие факторов Atg и вклад аутофагии как пути, и (2) зависимость от белка повторной сборки и укладки Гольджи (GRASP; рис.2) известный как GRASP55 и GRASP65 в клетках млекопитающих [7], dGRASP в Drosophila , GrpA в Dictyostelium и Grh2 в дрожжах [6,8,9,10,11].
Рис. 1
Секреция белка: обычный биосинтетический путь в сравнении с нетрадиционной секрецией посредством секреторной аутофагии. Хорошо разработанная парадигма традиционной секреции белка через ER, Гольджи и трафик пост-Гольджи (правая стрелка) по сравнению с процессом (левая стрелка) зависимой от аутофагии нетрадиционной секрецией цитозольных белков (секреторная аутофагия).Белки, предназначенные для обычной секреции, попадают в ER через сигнальные пептиды, тогда как цитозольные белки, предназначенные для секреторной аутофагии, секвестрируются в аутофагосомы для экспорта из клетки.
Рис. 2
Домены GRASP и характерные особенности. GRASP содержит два домена PDZ, внутреннюю белковую последовательность («внутренний лиганд»), которая связывается с одним из доменов PDZ, обеспечивающих гомоолигомеризацию, N-концевое ацилирование, которое облегчает ассоциацию GRASP с мембранами, и домен, богатый Ser-Pro, который является субстрат для фосфорилирования киназами Ser / Thr.Фосфорилирование модулирует взаимодействия GRASP и состояние олигомеризации.
Деградационная аутофагия
Аутофагия в настоящее время наиболее известна своей ролью в метаболизме, а также формой обмена органелл и белков и контроля качества [12,13]. Каноническая деградационная аутофагия (макроаутофагия) позволяет клеткам переваривать свои цитоплазматические компоненты в качестве эндогенного источника питательных веществ и энергии во время голодания или в качестве механизма очистки дефектных органелл и токсичных внутриклеточных агрегатов [14].Канонический путь аутофагии зависит от набора специфических для аутофагии факторов (называемых Atg и сопровождаемых числом), отвечающих на передачу сигналов выше по течению с помощью TOR, AMPK и др. Входов [12,15,16]. Факторы Atg ответственны за выполнение аутофагии и образование специализированных двойных мембранных органелл, называемых аутофагосомами. Факторы Atg организуются в несколько подкомплексов, включая комплекс Atg5-Atg12 / Atg16, который действует как концептуальный эквивалент лигаз E3 в системе убиквитина.Он регулирует C-концевое липидирование Atg8 (или его эквивалентов LC3 и GABARAP у млекопитающих) с помощью фосфатидилэтаноламина, необходимого для роста мембран аутофагосом [12]. Atg8-фосфатидилэтаноламин может влиять на связывание и слияние мембран [17,18], хотя аутофагические органеллы также подвергаются обычному слиянию мембран через SNAREs, канонические регуляторы слияния мембран в большинстве компартментов эукариотической клетки [19]. Мембранные предшественники для образования аутофагосом происходят из временных доменов на ER, называемых омегасомами.Есть также потенциальный вклад из других компартментов, таких как плазматическая мембрана, митохондрии и Гольджи. Для выполнения функций деградации аутофагосомы сливаются с лизосомами с образованием автолизосом, в которых захваченный груз в конечном итоге разрушается.
Как указано выше, предполагается, что аутофагия представляет собой в первую очередь катаболический путь лизосомной деградации. Представление об аутофагии как о чисто деградационном пути недавно было оспорено появлением трех независимых отчетов о роли аутофагии в нетрадиционной секреции Acb1 дрожжами [1,2,3] и IL-1β и других грузов (например,грамм. HMGB1 и IL-18) в клетках млекопитающих [4,5]. Эти новые идеи приписывают аутофагию неразрушающую функцию, проявляющуюся в нетрадиционной секреции белка (рис. 1). Более того, стало очевидно, что аутофагия широко пересекается с переносом и секрецией белков, включая эффекты на конститутивный путь биосинтеза [20], регулируемый экзоцитоз [21] и альтернативную сортировку интегральных мембранных белков по отношению к плазматической мембране [22].
Секреторная аутофагия и нетрадиционная секреция
Информация о том, как аутофагия способствует нетрадиционной секреции, получена в настоящее время из нескольких исследований [1,2,3,4,22].Наиболее полно он определяется у дрожжей, используя прототипный груз дрожжей для нетрадиционной секреции, Acb1 [1,2,3]. Роль аутофагии в нетрадиционной секреции и торговле белками — недавно признанная функция аутофагического аппарата. Не все нетрадиционно секретируемые белки секретируются одним и тем же механизмом. Нетрадиционная секреция — это универсальный термин для обозначения спектра разнообразных процессов [10]. Этот набор часто не связанных секреторных процессов доставляет посредством уникальных механизмов специфический белковый груз, локализованный в цитозоле, во внеклеточную среду или помогает в транспортировке интегральных мембранных белков к плазматической мембране без необходимости проходить через путь ER-G-PM [ 10].Только часть нетрадиционной секреции зависит от аутофагии. Когда аутофагия предоставляет специфических мембранных носителей для выполнения нетрадиционной секреции, эта подгруппа упоминается как аутосекреция [5], секреция типа III [6] или секреторная аутофагия, термин, который преимущественно используется в этом обзоре.
Секреторная против предшественников деградационной аутофагии
Связаны ли предшественники секреторной и деградационной аутофагии? Мембранная структура в дрожжах, называемая компартментом для нетрадиционной секреции белка (CUPS) [2], была идентифицирована как источник органелл или промежуточных продуктов для транспортировки нетрадиционной секреции, основанной на аутофагии.CUPS, термин, используемый в дрожжах, может быть связан (хотя это еще предстоит установить) с омегасомой клеток млекопитающих, которая действует как колыбель для генерации возникающих аутофагосом, обычно связанных с деградационной аутофагией [23]. CUPS формируется в общей окрестности, но не полностью совпадает с сайтами выхода ER, отмеченными Sec13 [2]. Организаторы сайтов выхода ER (Sec12 и Sec16) и компонентов COPII (Sec23 и Sec24, но не Sec13 и Sec31) необходимы для образования канонических аутофагосом у дрожжей [24].Участие регуляторов раннего секреторного пути в аутофагии также было отмечено в клетках млекопитающих [25,26]. Голодание вызывает как CUPS [2], так и омегасомы [23]. Эти структуры морфологически сходны, PI3P-положительны и декорированы факторами аутофагии (Atg). Поскольку сообщается, что CUPS не индуцируется рапамицином, было предложено отличить его от омегасом [2]. Однако в первоначальном описании омегасомы и ее роли в аутофагии наряду с ее положительностью на PI3P не сообщалось об использовании рапамицина и было основано исключительно на вызванной голоданием индукции аутофагии [23].Связь CUPS с хорошо известной преаутофагосомной структурой (PAS) у дрожжей также нуждается в уточнении, поскольку Sec23 COPII необходим для аутофагии посредством PAS [24], но его мутации не прерывают нетрадиционную секрецию Acb1. Сходным образом Sec12 важен для аутофагии [24], но, по-видимому, не требуется для образования CUPS у дрожжей [2]. Тонкие различия, описанные выше, могут быть техническими, но могут указывать на некоторую субкомпартментализацию доменов в пределах предшественников аутофагосомных органелл (CUPS, PAS и омегасомы), предназначенных для деградационной или секреторной аутофагии.
Секреторная аутофагия против деградационной аутофагии: выбор груза
Как груз, предназначенный для секреторной аутофагии, выбирается и отделяется от груза деградационной аутофагии? Пока это не исследовано. Потенциально актуально то, что CUPS содержит Vps23 [2]. Vps23, в системах млекопитающих, известный как TSG101, является членом комплекса эндосомальной сортировки, необходимого для транспорта (ESCRT) -I, связанного с мультивезикулярной эндосомной сортировкой, но также участвующего в ряде других процессов переноса.Однако компоненты ESCRT, отличные от Vps23, не встречаются в CUPS [2], а сам Vps23 не является необходимым для формирования CUPS, что указывает на то, что Vps23 может быть компонентом элементов сортировки, связанных с CUPS. Дальнейший интерес представляет то, что VPS23 / TSG101, в своей функции сортировки, может связываться с убиквитинированным грузом, типичным тегом распознавания для аутофагических адаптеров [27]. Роль в секреторной аутофагии для обычных адаптеров аутофагии, например p62, NBR1, NDP52 и оптинейрин еще предстоит изучить.
GRASP в нетрадиционной секреции и секреторной и канонической аутофагии
Белок, названный GRASP (рис.2), с ортологами в дрожжах [2,3,8], многоклеточных животных [28] и клетках млекопитающих [29,30,31], является единственным специфическим маркером, который, как известно, важен для секреции нетрадиционных белков [10]. Однако, как он действует в нетрадиционной секреции, основанной на аутофагии, неясно. Недавно опубликованное исследование [4,5] показывает, что GRASP55 (один из двух GRASP млекопитающих) также необходим для канонической деградационной аутофагии [4]. Таким образом, ранние секреторные и деградационные аутофагосомы могут происходить из общих предковых мембранных доменов с последующим дивергенцией и специализацией для секреции или переваривания захваченных субстратов.
Дрожжи GRASP (Grh2) перераспределяются в CUPS. Неизвестно, какие сигнальные события регулируют перераспределение дрожжевых ортологов GRASP в CUPS при голодании. В клетках млекопитающих GRASP55 и GRASP65 локализуются на ленте Гольджи, где они взаимодействуют с Golgin-45 и GM130 (рис. 3). Транслокация GRASP в клетках млекопитающих была обнаружена [4], и она может отражать события у дрожжей, хотя это еще предстоит установить. Можно ожидать, что существует два типа факторов, которые контролируют локализацию GRASP55 во время деградационной и секреторной аутофагии: (1) киназа (ы), которые могут влиять на состояние гомоолигомеризации GRASP55 и, таким образом, на связывание соседних мембран (как в ленте Гольджи) и (2) компартмент-специфические взаимодействующие партнеры, связывающиеся с доменами PDZ GRASP, таким образом привязывая их к подходящим мембранам, которые в конечном итоге сливаются.GRASP обладают способностью связывать мембраны посредством своих гомотипических взаимодействий между доменами PDZ и внутренними PDZ-связывающими мотивами («внутренний лиганд»; см. Рис. 2). Это морфологически лучше всего распознается в формировании, поддержании и разрушении лент Гольджи, где GRASPs, как известно, играют роль в соединении цистерн Гольджи [30,31] (рис. 3). Способность GRASP подвергаться гомоолигомеризации зависит от состояния фосфорилирования их С-концевых доменов, богатых Ser-Pro, и может быть нарушена, например.грамм. во время митоза (вызывающего рассредоточение по Гольджи) следуя сложным паттернам фосфорилирования несколькими киназами, включая ERK, CDK1 и PLK1 [30,31]. Помимо гомоолигомеризации через внутренний лиганд, GRASP55 и GRASP65 взаимодействуют в Golgi с Golgin-45 и GM130 соответственно. Хотя фосфорилирование GRASP может нарушить их гомоолигомеризацию (приводя к таким событиям, как нарушение митоза по Гольджи), неизвестно, могут ли подобные события привести к транслокации GRASP и модуляции взаимодействий с другими предполагаемыми партнерами, участвующими в секреторной аутофагии и нетрадиционной секреции в Генеральная.
Рис. 3
Гипотетическая модель и предполагаемые точки расхождения между деградационной и секреторной аутофагией. Шаги обсуждаются в тексте.
GRASP также выполняет свою функцию в обычной аутофагии, по крайней мере, в клетках млекопитающих [4]. Эквивалент дрожжевого GRASP важен для перемещения Atg9 при голодании [2], отражая локализацию Vps23 в CUPS. Влияние дрожжевого ортолога GRASP Grh2 на единственный интегральный мембранный фактор аутофагии (Atg9) косвенно подтверждает сообщаемую роль GRASPs млекопитающих (GRAPS55) в контроле инициации аутофагии [4].
Регуляция секреторной и деградационной аутофагии
В клетках млекопитающих в аутофагию вовлечены две близкородственные, но разные изоформы малой GTPase Rab8: Rab8a и Rab8b [4,32]. Есть указания на специализацию между Rab8a и Rab8b в секреторной и деградационной аутофагии (рис. 3). Было показано, что Rab8a и потенциально компоненты экзоцисты играют роль в секреторной аутофагии [4]. Напротив, Rab8b влияет на стадии созревания деградационной аутофагии [32].
Rab8b взаимодействует с протеинкиназой Ser / Thr TBK-1. TBK-1, в свою очередь, фосфорилирует два адаптера аутофагии: оптинейрин [33] и классический адаптер аутофагии p62 (секвестосома 1) [32]. Последний является ключевым фактором аутофагии [34] и членом-основателем нового подсемейства рецепторов распознавания образов, названных секвестосомоподобными рецепторами [27]. Эта функция TBK-1, вероятно, накладывается на тонический уровень базального фосфорилирования p62, осуществляемого казеинкиназой 2 по тому же остатку Ser-403 [35].Следует отметить, что TBK-1 является членом семейства киназ IKK, хорошо известных регуляторов врожденного иммунитета [36]. IKK могут быть каноническими (IKK-α и IKK-β) или атипичными / IKK-родственными киназами (IKKε и TBK-1). IKKα и IKKβ играют роль в индукции аутофагии [16]. Роль TBK-1 в созревании аутофагии указывает на последовательное действие в аутофагии канонических IKKs на инициирующих стадиях и TBK-1 в конце завершения процесса. Регулирует ли TBK-1 аутофагию в точке расхождения между секреторной и деградационной аутофагией (например, путем стимулирования последней) еще предстоит определить.
Роль аутофагии в секреции IL-1β и активации инфламмасом
В клетках млекопитающих несколько цитозольных белков секретируются различными путями нетрадиционной секреции [6,10]. Наиболее очевидным кандидатом на нетрадиционную секрецию посредством аутофагии является провоспалительный цитокин IL-1β, как было предложено [37] сразу после первых сообщений о молекулярном механизме секреторной аутофагии у дрожжей [1,3]. Однако ряд сходных отчетов, посвященных IL-1β с иммунологической точки зрения, показали наблюдения на мышах, лишенных Atg16L1 [38], с последующими механистическими анализами ex vivo и in vivo [4,39,40,41,42] , что аутофагия подавляет активацию IL-1β инфламмасомой.Этот негативный эффект аутофагии на активацию IL-1β является доминирующим эффектом аутофагии в стационарных условиях. Тем не менее, вклад секреторной аутофагии в высвобождение IL-1β из клеток был обнаружен как временная зависимая от аутофагии секреция IL-1β во время ранней острой фазы активации инфламмасом [4]. Последнее наблюдение подтверждает роль (хотя и временно обнаруживаемую) секреторной аутофагии в транспорте цитозольного IL-1β из клеток посредством процессов, зависимых от аутофагии.
IL-1β синтезируется как безлидерный цитозольный белок, секретируемый клетками через мембранные органеллы [43,44]. Секреторная аутофагия может способствовать этим нетрадиционным процессам секреции [4]. После секреции IL-1β связывается с рецептором IL-1 (IL-1RI), чтобы инициировать ряд воспалительных процессов, которые способствуют врожденному иммунитету, но также могут вызывать повреждение тканей [45]. Про-ИЛ-1β перерабатывается из своего неактивного цитозольного предшественника с помощью инфламмасом, мультибелкового комплекса, отвечающего на микробные продукты, называемые PAMP (патоген-ассоциированные молекулярные паттерны) и эндогенные молекулы, передающие сигнал о повреждении или опасные, называемые аларминами или DAMP (связанные с повреждением молекулярные паттерны) ) [46].Инфламмасома обычно состоит из трех частей: модуля обнаружения PAMP или DAMP в форме Nod-подобного рецептора (например, NLRP3) или модуля обнаружения эндогенной ДНК (высвобождаемой из митохондрий), такого как AIM2, адапторного белка концентратора ASC. и каспаза-1, которая, в свою очередь, ферментативно обрабатывает субстраты, например про-ИЛ-1β в зрелые биологически активные продукты, такие как ИЛ-1β. Аутофагия косвенно подавляет активацию IL-1β, снижая количество эндогенных источников, таких как активные формы кислорода (ROS) или DAMP, такие как митохондриальная ДНК, высвобождаемая деполяризованными или иным образом неопрятными митохондриями, накапливающимися в клетках с дефицитом аутофагии [39,40] и распознаваемыми Компоненты инфламмасомы.Аутофагия также может действовать посредством предполагаемой аутофагической деградации составляющих инфламмасом [41,42,47]. В принципе, основная роль аутофагии в контексте инфламмасом заключается в поддержании чистоты внутренней части клетки от эндогенных DAMP, чтобы эти агонисты инфламмасом не вызывали стерильное воспаление и патологическое повреждение ткани. Аутофагия также играет роль переноса мембран, способствуя острой нетрадиционной секреции IL-1β, но этот вклад маскируется в стационарных условиях [4].Секреторная аутофагия также способствует высвобождению других цитозольных субстратов инфламмасом, например IL-18 и другие alarmins, такие как белок B1 группы высокой подвижности (HMGB1) [4]. Таким образом, аутофагия играет двойную роль в активации инфламмасом и секреции IL-1β, а также в высвобождении других alarmins из клетки. Важно признать эту двойственность следующим образом: (1) положительный вклад аутофагии в быструю доставку IL-1α и аларминов из клетки является проявлением секреторной аутофагии как процесса переноса через мембрану [4], и (2) Тоническое подавление активации инфламмасом является проявлением деградационной аутофагии в ее функции как процесса контроля качества в цитоплазме.
Отличается ли роль аутофагии в активации и секреции IL-1α от воздействия на IL-1β?
Другой провоспалительный путь, связанный, но отличный от активации инфламмасом, зависит от аутофагии. Этот путь включает IL-1α, провоспалительный цитокин, который имеет две общие черты с IL-1β: они оба являются цитоплазматическими белками, и оба они задействуют одни и те же рецепторы и нижестоящую передачу сигналов после внеклеточного высвобождения и связывания с IL-1RI. Однако IL-1α активируется и секретируется способом, который отличается от процессинга и активации про-IL-1β.IL-1α продуцируется в виде цитозольной проформы, которая может обрабатываться кальпаином или другими протеазами [48] и активно экспортироваться из клетки [49,50] или пассивно высвобождаться при гибели клетки [51]. Сообщалось, что секреция IL-1α включает как независимые от каспазы 1, так и зависимые от каспазы 1 пути [52]. Макрофаги Caspase 1 — / — , стимулированные LPS, демонстрируют снижение секреции IL-1α на 20-30% по сравнению с контролем [53], что указывает на то, что основной путь секреции IL-1α не зависит от каспазы 1.Интересно, что, несмотря на это расхождение, клетки с дефектом аутофагии (например, Atg5 fl / fl LysM-Cre + макрофаги) также генерируют избыток IL-1α. Это согласуется с существованием другого основного, независимого от воспаления пути активации [50], который также усиливается в отсутствие цитоплазматических функций аутофагии [4,39,40,41,42]. Этот путь разделяет с инфламмасомой-IL-1β самые вышестоящие триггеры — например, АФК, исходящие из неопрятных митохондрий в клетках с дефицитом аутофагии.Однако он отличается нижней, исполнительной частью пути. АФК могут активировать кальпаин [54,55], который, в свою очередь, активирует IL-1α [50].
Открытия оси ROS-кальпаин в активации IL-1α [50] и сообщения о передаче сигналов ROS-RLR [56] распространяют провоспалительные явления на невоспалительные пути ниже по течению от накопления дисфункциональных митохондрий и ROS в клетках с дефицитом аутофагии. Другие изменения с воспалительными последствиями были отмечены у мышей с Atg5-дефицитными макрофагами [57,58].Неизвестно, является ли IL-1α субстратом для альтернативного секреторного пути, как это может быть в случае IL-1β [4]. К настоящему времени изучена только отрицательная роль аутофагии в процессах активации, предшествующих секреции IL-1α [50]. Кинетические исследования высвобождения IL-1α могут помочь выявить возможный положительный вклад аутофагии в физический акт секреции IL-1α по сравнению с доминирующей ролью аутофагии в сдерживании вышестоящих триггеров активации.
Заключительные замечания
На данный момент генетические исследования подтверждают существование секреторной аутофагии.Остается определить, обеспечивает ли секреторная аутофагия специфическими мембранными переносчиками для захвата цитозольных белков и их секретирования вне клетки и каким образом. Точные биологические механизмы клетки, выполняющие секреторную аутофагию, адаптеры для отбора грузов, переключатели, разделяющие деградационную и секреторную аутофагию, а также другие аспекты векторных мембранных транспортов и сортировки белковых грузов еще предстоит определить. Необходимо понимать пересечение этого пути с ролью GRASP.Спектр цитозольных белков, экстернализованных секреторной аутофагией, и объем их внеклеточных функций также предстоит каталогизировать, чтобы в полной мере оценить биологическое и медицинское значение этого потенциального пути.
Мы предупреждаем читателя, что модели, изображенные на рисунках в этом обзоре, являются гипотетическими и должны служить не как твердое резюме того, что известно, а как умозрительная отправная точка и платформа для тестирования и, если необходимо, опровержения этих моделей в надежде, что это послужит стимулом для дальнейших исследований.Независимо от деталей, секреторная аутофагия — это область исследований, которая уже расширяет сферу влияния аутофагии с чисто внутрицитоплазматической области на внеклеточное пространство. Более того, существование секреторной аутофагии свидетельствует о том, что аутофагия — это не только процесс деградации лизосом, но и может играть важную роль в биогенезе во внеклеточной доставке биоактивных молекул. Даже если принять эту расширенную концепцию, общим знаменателем для обоих процессов по-прежнему будет удаление макромолекул и органелл из цитоплазмы, которое может происходить путем разложения или секреции.
Благодарности
В.Д. выражает признательность за недавнюю и текущую поддержку со стороны AI042999, AI069345 и ARRA RC1AI086845 из Фонда национальных институтов здравоохранения Америки по колиту CCFA2053 и гранта Билла и Мелинды Гейтс на исследование грантов. E.F.C. был поддержан приложением 3R01AI042999-13S1. Эта работа была частично поддержана NCRR и Национальным центром развития трансляционных наук NIH Grant UL1 TR000041.
Список литературы
- Manjithaya R, Anjard C, Loomis WF, Subramani S: Нетрадиционная секреция Pichia pastoris Acb1 зависит от белка GRASP, пероксисомных функций и образования аутофагосом.J Cell Biol 2010; 188: 537-546.
- Bruns C, McCaffery JM, Curwin AJ, Duran JM, Malhotra V: Биогенез нового компартмента для опосредованной аутофагосомой нетрадиционной секреции белка. J Cell Biol 2011; 195: 979-992.
- Duran JM, Anjard C, Stefan C, Loomis WF, Malhotra V: Нетрадиционная секреция Acb1 опосредуется аутофагосомами.J Cell Biol 2010; 188: 527-536.
- Дюпон Н., Цзян С., Пилли М., Орнатовски В., Бхаттачарья Д., Деретик В. Нетрадиционный секреторный путь, основанный на аутофагии, для внеклеточной доставки IL-1beta. EMBO J 2011; 30: 4701-4711.
- Deretic V, Jiang S, Dupont N: Аутофагия пересекается с традиционной и нетрадиционной секрецией в развитии, ремоделировании и воспалении тканей.Тенденции Cell Biol 2012; 22: 397-406.
- Rabouille C, Malhotra V, Nickel W: Разнообразие нетрадиционной секреции белка. J Cell Sci 2012, в печати.
- Shorter J, Watson R, Giannakou ME, Clarke M, Warren G, Barr FA: GRASP55, второй белок GRASP млекопитающих, участвующий в укладке цистерн Гольджи в бесклеточную систему.EMBO J 1999; 18: 4949-4960.
- Cabral M, Anjard C, Malhotra V, Loomis WF, Kuspa A: Нетрадиционная секреция AcbA в Dictyostelium discoideum через везикулярный промежуточный продукт. Эукариотическая клетка 2010; 9: 1009-1017.
- Kinseth MA, Anjard C, Fuller D, Guizzunti G, Loomis WF, Malhotra V: Связанный с Гольджи белок GRASP необходим для нетрадиционной секреции белка во время развития.Cell 2007; 130: 524-534.
- Никель W, Rabouille C: механизмы регулируемой нетрадиционной секреции белка. Нат Рев Мол Cell Biol 2009; 10: 148-155.
- Джулиани Ф., Грив А., Рабуй С: Нетрадиционная секреция: стресс для GRASP.Curr Opin Cell Biol 2011; 23: 498-504.
- Mizushima N, Yoshimori T, Ohsumi Y: Роль белков Atg в формировании аутофагосом. Энн Рев Селл Дев Биол 2011; 27: 107-132.
- Рубинштейн Д.К., Codogno P, Levine B: Модуляция аутофагии как потенциальная терапевтическая цель для различных заболеваний.Nat Rev Drug Discov 2012; 11: 709-730.
- Мидзусима Н., Комацу М: Аутофагия: обновление клеток и тканей. Cell 2011; 147: 728-741.
- Иган Д.Ф., Шакелфорд Д.Б., Михайлова М.М., Гелино С., Конц Р.А., Майр В., Васкес Д.С., Джоши А., Гвинн Д.М., Тейлор Р., Асара Дж. М., Фитцпатрик Дж., Диллин А., Виоллет Б., Кунду М., Хансен М., Шоу Р.Дж. : Фосфорилирование ULK1 (hATG1) AMP-активированной протеинкиназой связывает восприятие энергии с митофагией.Наука 2011; 331: 456-461.
- Криолло А., Нисо-Сантано М., Малик С.А., Мишо М., Морселли Э., Марино Дж., Лачкар С., Архипенко А.В., Харпер Ф, Пьерон Дж., Рейн Дж. К., Ниномия-Цудзи Дж., Фуэнтес Дж. М., Лавандеро С., Галлуцци Л., Майури MC, Kroemer G: Подавление аутофагии TAB2 и TAB3.Embo J 2011; 30: 4908-4920.
- Накатогава Х., Ичимура Й., Осуми У.: Atg8, убиквитин-подобный белок, необходимый для образования аутофагосом, опосредует связывание мембран и гемифузию. Cell 2007; 130: 165-178.
- Weidberg H, Shpilka T, Shvets E, Abada A, Shimron F, Elazar Z: N-концы LC3 и GATE-16 опосредуют процессы слияния мембран, необходимые для биогенеза аутофагосом.Dev Cell 2011; 20: 444-454.
- Наир У, Джотвани А., Генг Дж., Гаммо Н., Ричерсон Д., Йен В.Л., Гриффит Дж., Наг С., Ван К., Мосс Т., Баба М., МакНью Дж. А., Цзян Х, Реджиори Ф., Мелия Т.Дж., Клионски Д.Д.: протеины SNARE. необходимы для макроаутофагии. Cell 2011; 146: 290-302.
- Нарита М., Янг А.Р., Аракава С., Самараджива С.А., Накашима Т., Йошида С., Хонг С., Берри Л.С., Райхельт С., Феррейра М., Таваре С., Иноки К., Симидзу С.: Пространственная связь mTOR и аутофагии увеличивает секреторные фенотипы.Наука 2011; 332: 966-970.
- ДеСелм К.Дж., Миллер Б.К., Зоу В., Битти В.Л., ван Меель Э., Такахата Ю., Клумперман Дж., Туз С.А., Тейтельбаум С.Л., Virgin HW: белки аутофагии регулируют секреторный компонент резорбции остеокластической кости. Dev Cell 2011; 21: 966-974.
- Gee HY, Noh SH, Tang BL, Kim KH, Lee MG: Спасение трафика deltaF508-CFTR через GRASP-зависимый нетрадиционный путь секреции.Cell 2011; 146: 746-760.
- Ax EL, Walker SA, Manifava M, Chandra P, Roderick HL, Habermann A, Griffiths G, Ktistakis NT: образование аутофагосом из мембранных компартментов, обогащенных фосфатидилинозитол-3-фосфатом и динамически связанных с эндоплазматическим ретикулумом.J. Cell Biol. 2008; 182: 685-701.
- Ishihara N, Hamasaki M, Yokota S, Suzuki K, Kamada Y, Kihara A, Yoshimori T., Noda T, Ohsumi Y: Аутофагосома требует специфических ранних белков Sec для своего образования и NSF / SNARE для слияния вакуолей. Mol Biol Cell 2001; 12: 3690-3702.
- Zoppino FC, Militello RD, Slavin I, Alvarez C, Colombo MI: Формирование аутофагосом зависит от малой GTPase Rab1 и функциональных сайтов выхода ER.Трафик 2010; 11: 1246-1261.
- Winslow AR, Chen CW, Corrochano S, Acevedo-Arozena A, Gordon DE, Peden AA, Lichtenberg M, Menzies FM, Ravikumar B, Imarisio S, Brown S, O’Kane CJ, Rubinsztein DC: α-синуклеин нарушает макроаутофагию: последствия при болезни Паркинсона. J Cell Biol 2010; 190: 1023-1037.
- Деретик V: Аутофагия как парадигма врожденного иммунитета: расширение диапазона и репертуара рецепторов распознавания образов. Курр Опин Иммунол 2012; 24: 21-31.
- Schotman H, Karhinen L, Rabouille C: dGRASP-опосредованная секреция неканонического интегрина необходима для ремоделирования эпителия Drosophila .Dev Cell 2008; 14: 171-182.
- Barr FA: Очистка и функциональные взаимодействия GRASP55 с Rab2. Методы Enzymol 2005; 403: 391-401.
- Truschel ST, Zhang M, Bachert C, Macbeth MR, Linstedt AD: Аллостерическая регуляция зависимого от белка GRASP связывания мембраны Гольджи путем митотического фосфорилирования.J Biol Chem 2012; 287: 19870-19875.
- Джарвела Т, Линстедт А: Golgi GRASPs: подрабатывающие мембранные привязи. Цитоскелет здоровья клетки 2012; 4: 37-47.
- Пилли М., Арко-Менса Дж., Понпуак М., Робертс Э., Мастер С., Манделл М.А., Дюпон Н., Орнатовски В., Цзян С., Брадфут С.Б., Бруун Дж. А., Хансен Т.Э., Йохансен Т., Деретич В.: TBK-1 способствует аутофагии. опосредованная антимикробная защита путем контроля созревания аутофагосом.Иммунитет 2012; 37: 223-234.
- Wild P, Farhan H, McEwan DG, Wagner S, Rogov VV, Brady NR, Richter B, Korac J, Waidmann O, Choudhary C, Dotsch V, Bumann D, Dikic I: фосфорилирование рецептора аутофагии оптинейрина ограничивает рост Salmonella . Наука 2011; 333: 228-233.
- Bjorkoy G, Lamark T, Brech A, Outzen H, Perander M, Overvatn A, Stenmark H, Johansen T: p62 / SQSTM1 образует белковые агрегаты, разлагаемые аутофагией, и оказывает защитное действие на гибель клеток, вызванную хантинтином. J. Cell Biol 2005; 171: 603-614.
- Мацумото Г., Вада К., Окуно М., Куросава М., Нукина Н.: Фосфорилирование серина 403 p62 / SQSTM1 регулирует селективный аутофагический клиренс убиквитинированных белков.Mol Cell 2011; 44: 279-289.
- Перкинс Н.Д .: Интеграция клеточных сигнальных путей с функцией NF-kappaB и IKK. Nat Rev Molecular Cell Biol 2007; 8: 49-62.
- Пфеффер С.Р .: Нетрадиционная секреция экзоцитоза аутофагосом.J Cell Biol 2010; 188: 451-452.
- Сайто Т., Фудзита Н., Джанг М. Х., Уэмацу С., Ян Б. Г., Сато Т., Омори Х., Нода Т., Ямамото Н., Комацу М., Танака К., Кавай Т., Цудзимура Т., Такеучи О, Йошимори Т., Акира С.: потеря белок аутофагии Atg16L1 усиливает индуцированную эндотоксином продукцию IL-1beta.Природа 2008; 456: 264-268.
- Zhou R, Yazdi AS, Menu P, Tschopp J: Роль митохондрий в активации воспаления NLRP3. Природа 2011; 469: 221-225.
- Nakahira K, Haspel JA, Rathinam VA, Lee SJ, Dolinay T., Lam HC, Englert JA, Rabinovitch M, Cernadas M, Kim HP, Fitzgerald KA, Ryter SW, Choi AM: белки аутофагии регулируют врожденные иммунные ответы, подавляя высвобождение митохондриальная ДНК, опосредованная инфламмасомой NALP3.Нат Иммунол 2011; 12: 222-230.
- Harris J, Hartman M, Roche C, Zeng SG, O’Shea A, Sharp FA, Lambe EM, Creagh EM, Golenbock DT, Tschopp J, Kornfeld H, Fitzgerald KA, Lavelle EC: Autophagy контролирует секрецию IL-1beta, ориентируясь на профессионалов. -IL-1beta для разложения. J Biol Chem 2011; 286: 9587-9597.
- Ши С.С., Шендеров К., Хуанг Н.Н., Кабат Дж., Абу-Асаб М., Фицджеральд К.А., Шер А., Керл Дж.А.: Активация аутофагии воспалительными сигналами ограничивает выработку IL-1beta, направляя убиквитиновые инфламмасомы для разрушения. Нат Иммунол 2012; 13: 255-263.
- Rubartelli A, Cozzolino F, Talio M, Sitia R: новый секреторный путь для интерлейкина-1 бета, белка, у которого отсутствует сигнальная последовательность.EMBO J 1990; 9: 1503-1510.
- Qu Y, Franchi L, Nunez G, Dubyak GR: Неклассическая секреция бета-интерлейкина-1, стимулируемая рецепторами P2X7, зависит от активации инфламмасом и коррелирует с высвобождением экзосом в макрофагах мышей. J. Immunol 2007; 179: 1913-1925.
- Dinarello CA: член семейства IL-1 требует обработки каспазой-1 и передает сигналы через рецептор ST2.Иммунитет 2005; 23: 461-462.
- Ратинам В.А., Ваная С.К., Фицджеральд К.А.: Регулирование передачи сигналов воспаления. Нат Иммунол 2012; 13: 333-332.
- Пераль де Кастро С., Джонс С.А., Ни Челлай С., Хирнден К.А., Уильямс Л., Винтер Дж., Лавель ЕС, Миллс К.Х., Харрис Дж .: Аутофагия регулирует секрецию ИЛ-23 и врожденные Т-клеточные ответы посредством воздействия на секрецию ИЛ-1.J. Immunol 2012; 189: 4144-4153.
- Афонина И.С., Тайнан Г.А., Лог С.Е., Каллен С.П., Боты М., Лути А.Ю., Ривз Е.П., МакЭлвейни Н.Г., Медема Дж. П., Лавель Е.С., Мартин С.Дж.: Гранзим B-зависимый протеолиз действует как переключатель для усиления провоспалительной активности IL 1альфа. Mol Cell 2011; 44: 265-278.
- Yazdi AS, Guarda G, Riteau N, Drexler SK, Tardivel A, Couillin I, Tschopp J: Наночастицы активируют пириновый домен NLR, содержащий 3 (Nlrp3) инфламмасому, и вызывают воспаление легких за счет высвобождения IL-1alpha и IL-1beta. Proc Natl Acad Sci USA 2010; 107: 19449-19454.
- Castillo E, Dekonenko A, Arko-Mensah J, Mandell M, Dupont N, Jiang S, Delgado-Vargas M, Timmins G, Bhattacharya D, Yang H, Hutt J, Lyson C, Dobos K, Deretic V: Autophagy защищает от активных туберкулез, подавляя бактериальную нагрузку и воспаление. Proc Natl Acad USA 2012, в печати.
- Чен С.Дж., Коно Х., Голенбок Д., Рид Г., Акира С., Рок К.Л.: Идентификация ключевого пути, необходимого для стерильной воспалительной реакции, запускаемой умирающими клетками. Нат Мед 2007; 13: 851-856.
- Gross O, Yazdi AS, Thomas CJ, Masin M, Heinz LX, Guarda G, Quadroni M, Drexler SK, Tschopp J: Активаторы инфламмасомы индуцируют секрецию интерлейкина-1альфа разными путями с дифференциальной потребностью в протеазной функции каспазы-1.Иммунитет 2012; 36: 388-400.
- Schott WH, Haskell BD, Tse HM, Milton MJ, Piganelli JD, Choisy-Rossi CM, Reifsnyder PC, Chervonsky AV, Leiter EH: Каспаза-1 не требуется для диабета типа 1 у мышей NOD. Диабет 2004; 53: 99-104.
- Ли Ю., Арнольд Дж. М., Пампилло М., Бабва А. В., Пэн Т.: Таурин предотвращает гибель кардиомиоцитов, ингибируя активацию кальпаина, опосредованную НАДФН-оксидазой.Free Radic Biol Med 2009; 46: 51-61.
- Шарма А.К., Рорер Б. Устойчивое повышение внутриклеточного цГМФ вызывает окислительный стресс, запускающий кальпаин-опосредованный апоптоз при дегенерации фоторецепторов. Curr Eye Res 2007; 32: 259-269.
- Tal MC, Sasai M, Lee HK, Yordy B, Shadel GS, Iwasaki A: Отсутствие аутофагии приводит к зависимому от активных форм кислорода усилению передачи сигналов RLR.Proc Natl Acad Sci USA 2009; 106: 2770-2775.
- Cadwell K, Liu JY, Brown SL, Miyoshi H, Loh J, Lennerz JK, Kishi C, Kc W, Carrero JA, Hunt S, Stone CD, Brunt EM, Xavier RJ, Sleckman BP, Li E, Mizushima N, Stappenbeck TS , Virgin HWT: ключевая роль в аутофагии и гене аутофагии Atg16l1 в кишечных клетках Панета мыши и человека.Природа 2008; 456: 259-263.
- Cadwell K, Patel KK, Maloney NS, Liu TC, Ng AC, Storer CE, Head RD, Xavier R, Stappenbeck TS, Virgin HW: Взаимодействие вируса и гена чувствительности определяет фенотипы гена болезни Крона Atg16L1 в кишечнике. Cell 2010; 141: 1135-1145.
Автор Контакты
Доктор.Vojo Deretic
Департамент молекулярной генетики и микробиологии
Центр медицинских наук Университета Нью-Мексико
915 Camino de Salud, NE, Albuquerque, NM 87131 (USA)
E-Mail [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 4 декабря 2012 г.
Принято: 27 декабря 2012 г.
Опубликовано в Интернете: 22 февраля 2013 г.
Дата выпуска: июль 2013 г.
Количество страниц для печати: 9
Количество рисунков: 3
Количество столов: 0
ISSN: 1662-811X (печатный)
eISSN: 1662-8128 (онлайн)
Для дополнительной информации: https: // www.karger.com/JIN
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Регуляция сортировки и перемещения родопсина после Гольджи с помощью его С-концевой последовательности QVS (A) PA
Abstract
Несколько мутаций, вызывающих тяжелые формы аутосомно-доминантного пигментного ретинита у человека, кластер в С-концевой области родопсина.Недавние исследования показали участие С-концевого домена родопсина в его транспортировке на специализированных пост-Гольджи мембранах к стержневому внешнему сегменту фоторецепторной клетки. Здесь мы использовали синтетические пептиды в качестве конкурентных ингибиторов переноса родопсина в бесклеточную систему сетчатки лягушки, чтобы очертить потенциальную регуляторную последовательность в пределах С-конца родопсина и смоделировать влияние тяжелых аллелей пигментного ретинита на сортировку родопсина. С-концевая последовательность родопсина QVS (A) PA высоко консервативна среди различных видов.Пептиды, которые соответствуют С-концу бычьего (аминокислоты 324–348) и лягушачьего (аминокислоты 330–354) родопсина, ингибировали трафик после Гольджи на 50% и 60% соответственно и задерживали вновь синтезированный родопсин в транс-Гольджи. сеть. Пептиды, соответствующие цитоплазматическим петлям родопсина и другим контрольным пептидам, не оказывали влияния. Когда три встречающиеся в природе мутации: Q344ter (без последних пяти аминокислот QVAPA), V345M и P347S были введены в C-концевой пептид лягушки, ингибирующая активность пептидов больше не определялась.Эти наблюдения предполагают, что аминокислоты QVS (A) PA содержат сигнал, который распознается специфическими факторами в сети транс-Гольджи. Отсутствие распознавания этой последовательности из-за мутаций в последних пяти аминокислотах, вызывающих аутосомно-доминантный пигментный ретинит, скорее всего, приводит к аномальному образованию мембран пост-Гольджи и аберрантной субклеточной локализации родопсина.
Родопсин и связанные с ним белки и липиды доставляются поляризованной сортировкой на пост-Гольджи-мембранах к внешнему сегменту стержня (ROS), специализированному домену фоторецепторных клеток сетчатки (1–4).После правильной локализации в АФК родопсин и другие факторы участвуют в каскаде сигнальных взаимодействий, запускаемых светом (5). Сохранение поляризованной организации на протяжении непрерывного обновления АФК, что приводит к добавлению до 3 мкм 2 / мин мембраны (6), имеет первостепенное значение для здоровья фоторецепторных клеток. В некоторых случаях потеря полярности клеток предвещает начало дегенерации сетчатки и слепоты (7).
Пигментный ретинит включает гетерогенную группу дегенераций сетчатки, которые характеризуются сходными клиническими проявлениями, но вызваны мутациями в более чем 50 различных генах (8).Мутации, обнаруженные в гене родопсина, составляют 10% всех случаев и представляют собой наиболее частую известную причину пигментного ретинита (9). Более 70 мутаций вызывают аутосомно-доминантную форму заболевания (АДРП) (10). Хотя внутриклеточная судьба мутантного родопсина в настоящее время неясна, экспрессия мутантных аллелей, по-видимому, запускает взаимодействия, которые приводят к патологическим изменениям в фоторецепторных клетках. Конечным ответом является запуск апоптотического каскада, который приводит к гибели клеток и дегенерации сетчатки (11, 12).
Гистопатологические данные в образцах пациентов (7) и исследования на трансгенных животных (10, 13) предполагают, что некоторые формы ADRP приводят к изменению доставки родопсина к ROS. Мы изучали транспортировку родопсина и мембранную доставку ROS на субклеточном уровне. Недавно мы сообщили о характеристиках пост-Гольджи-мембран, которые переносят родопсин на АФК (1–3, 14–18). Бесклеточная система сетчатки лягушки была создана для изучения транспорта родопсина через различные биосинтетические компартменты в фоторецепторных клетках (2).Эта система поддерживает образование родопсин-несущих мембран пост-Гольджи АТФ-, ГТФ- и цитозоль-зависимым образом (2). После импульсного мечения in vivo кинетику движения радиоактивно меченного родопсина через субклеточные компартменты можно отслеживать после равновесного центрифугирования на градиентах плотности сахарозы. Из-за своей уникальной низкой плавучести мембраны, несущие родопсин, пост-Гольджи, могут быть обогащены> 85% и отделены от сети Гольджи и транс-Гольджи (TGN) (1).Несущие родопсин мембранные носители пост-Гольджи, образованные in vitro , оказались неотличимы от тех, что были сформированы in vivo по нескольким критериям, включая отчетливый профиль мембран-ассоциированных малых GTPases семейства rab (2).
Здесь мы применили эту систему для оценки влияния мутаций родопсина, обнаруженных в ADRP, на его сортировку и доставку. Особенно тяжелые формы ADRP вызываются мутациями, которые группируются в пяти С-концевых аминокислотах родопсина (19, 20).Трансгенные животные, несущие эти мутации, обнаруживают дефекты доставки родопсина к АФК (10, 13). С-концевая последовательность родопсина QVS (A) PA является высококонсервативной среди различных видов, а родопсин лягушки и человека демонстрирует 85% идентичности и 95% общего сходства на уровне аминокислот (21). Кроме того, аминокислоты, мутировавшие в ADRP, сохраняются в последовательности лягушки. Эти аминокислоты не участвуют в каких-либо светозависимых функциях (13, 22), и было высказано предположение, что они могут участвовать в сортировке родопсина (2, 10, 13).Ранее мы сообщали, что mAb, антигенный сайт которого находится в пределах девяти С-концевых аминокислот родопсина, ингибирует его перенос после Гольджи в нашу бесклеточную систему (2). В этой работе мы исследовали потенциальную нацеливающую функцию С-концевых аминокислот родопсина. Мы картировали домен, который направляет внутриклеточный транспорт, используя синтетические пептиды, соответствующие С-концам родопсинов лягушки и млекопитающих в качестве конкурентных ингибиторов переноса родопсина в бесклеточной системе.Мы сообщаем, что пять C-концевых остатков QVS (A) PA играют критическую роль в регуляции сортировки родопсина в специфических пост-Гольджи-мембранах на уровне TGN. Эти наблюдения показывают, что неправильное распознавание мутантного родопсина у пациентов с ADRP может приводить конкретно к аномальному образованию мембран пост-Гольджи или ошибочному нацеливанию мутантного родопсина.
МАТЕРИАЛЫ И МЕТОДЫ
Южных леопардовых лягушек, Rana berlandieri , (100–250 г), приобретенных в Ране (Браунсвилл, Техас), содержали при 12-часовом цикле свет / темнота.Смесь для мечения белков [ 35 S] -Express (1000 Ки / ммоль) была получена от DuPont / NEN. АТФ, креатинфосфат, креатинфосфокиназа (800 единиц / мг) и гексокиназа (450 единиц / мг) были от Boehringer Mannheim.
Синтез пептидов.
Пептиды, соответствующие последовательности лягушки (21) и бычьего родопсина (23, 24), были синтезированы твердофазным методом с использованием флуоренилметоксикарбонильных производных аминокислот на автоматическом синтезаторе (модель 431A, Applied Biosystems).После снятия защиты пептиды очищали препаративной обращенно-фазовой жидкостной хроматографией на колонке 2,5 × 25 см Partisil-10 ODS-3 (Whatman). Были протестированы следующие пептиды: бычьи аминокислоты 3–14, 63–75, 141–153, 234–245, 231–252, 310–321, 324–348, 330–348 и 331–342, а также аминокислоты лягушки. 330–354, 330–349, 330–354 V351M и 330–354 P353S.
Импульсное маркирование сетчатки лягушки и получение обогащенного фоторецепторами постнуклеарного супернатанта (ПНС).
Все эксперименты проводились при тусклом красном свете.Лягушек адаптировали к темноте за 2 часа до эксперимента по двум причинам: (–) изоляции сетчатки способствует ретракция пигментного эпителия в темноте, и ( ii ) субклеточное распределение органелл хорошо установлено для родопсинсодержащие мембраны, адаптированные к темноте (1). Выделенные сетчатки лягушки инкубировали в оксигенированной среде со смесью белков, меченных [ 35 S] -Express (25 мкКи / сетчатка) при 22 ° C в течение 1 часа. Фракционирование сетчатки и приготовление ПНС, обогащенной фоторецепторными биосинтетическими мембранами, проводили, как описано (2).
In vitro Инкубация ПНС, обогащенной фоторецепторами.ПНС с радиоактивной меткой предварительно инкубировали с синтетическими пептидами (растворенными в 50 мкл 10 мМ Hepes-KOH, pH 7,0) в течение 30 мин на льду. Стандартный анализ бесклеточного образования мембран после Гольджи был следующим: к 1 мл ПНС в 0,25 М сахарозе (полученной из семи радиоактивно меченных сетчаток) добавляли 100 мкл 10-кратного концентрированного исходного буферного раствора, чтобы получить конечную концентрацию 25. мМ Hepes-KOH, pH 7.0,25 мМ KCl и 2,5 мМ MgAc 2 . Анализ был инициирован добавлением 50 мкл регенерирующей системы АТФ и переносом на 22 ° C (2). Анализ завершали добавлением 0,2 М EDTA до конечной концентрации 3 мМ.
После завершения формирования бесклеточной мембраны после Гольджи аналитические смеси наносили на 10 мл линейных градиентов сахарозы 20–39% (мас. / Мас.). После центрифугирования при 28000 об / мин (100000 г av ) в роторе SW 40 (Beckman) в течение 15 ч при 4 ° C, четырнадцать 0.Фракции объемом 9 мл собирали с вершины градиента. Субклеточные фракции объединяли в соответствии с кинетикой приобретения ими радиоактивно меченного родопсина, как описано (2) следующим образом: пул 1 = фракции 1–3, 2 = 4–6, 3 = 7–8, 4 = 9–10, 5 = 11–12 и 6 = 13–14, разбавляли 10 мМ трис ацетатом, pH 7,4 и центрифугировали при 70 000 об / мин (336 000 г av ) в течение 30 минут в роторе 70,1 Ti (Beckman). Осадки ресуспендировали в 10 мМ трис-ацетате, pH 7,4 и аликвотировали для анализа с помощью SDS / PAGE.
Гель-электрофорез и количественный анализ радиоактивно меченного родопсина в субклеточных фракциях сетчатки.
SDS / PAGE выполняли, как описано (2). Высушенные гели SDS подвергали количественному анализу 35 S-меченного родопсина в субклеточных фракциях сетчатки в PhosphorImager (Molecular Dynamics), в то время как изображения гелей получали авторадиографией при -85 ° C с использованием пленки Kodak BioMax MR.
РЕЗУЛЬТАТЫ
Бесклеточная система сетчатки для торговли родопсином.
Несущие родопсин пост-Гольджи-мембраны образуются после импульсного мечения in vivo с последующим in vitro погоня в бесклеточной системе сетчатки лягушки, полученной из обогащенной фоторецепторами ПНС АТФ-, ГТФ- и цитозоль-зависимым образом (2). Рис. 1 иллюстрирует АТФ-зависимый перенос радиоактивно меченного родопсина во фракцию после Гольджи во время инкубации в бесклеточной системе. В этом анализе изолированные сетчатки лягушки сначала подвергаются импульсной метке в течение 1 часа, так что основная часть вновь синтезированного родопсина локализуется в Гольджи.Следовательно, большая часть определяемого радиоактивно меченного родопсина соответствует форме Гольджи с усеченными олигосахаридами. Комплекс Гольджи идентифицируется по активности галактозилтрансферазы транс-цистерн Гольджи, как описано ранее (1). В присутствии АТФ и АТФ-регенерирующей системы внутриклеточный трафик продолжается in vitro . Как показано на рис.1 (+ АТФ), после 2-часовой инкубации с АТФ содержание радиоактивно меченного родопсина по Гольджи и эндоплазматическому ретикулуму (ЭР) значительно уменьшилось, мембраны TGN стали обогащены вновь синтезированным родопсином, а пост-Гольджи-мембраны содержали высокие уровни радиоактивно меченного родопсина, что согласуется с ранее опубликованными результатами (2).В контрольном образце, содержащем АТФ-истощающую систему, рис.1 (-АТФ), радиоактивно меченный родопсин не перераспределялся на TGN и пост-Гольджи-мембраны, что указывает на полное прекращение трафика в отсутствие АТФ, что согласуется с ранее описанными характеристиками. системы (2).
Рисунок 1Доставка родопсина к мембранам после Гольджи в бесклеточной системе сетчатки. Выделенные сетчатки лягушки подвергали импульсной метке в течение 60 минут, а радиоактивно меченную ПНС инкубировали в течение 2 часов в присутствии или в отсутствие АТФ.После разделения градиента сахарозы субклеточные фракции объединяли в соответствии с кинетикой приобретения ими вновь синтезированного родопсина, как описано ранее (2). Аликвоты, соответствующие радиоактивно меченным мембранным белкам из двух сетчаток, разделяли с помощью SDS / PAGE и авторадиографировали. В отсутствие АТФ (-АТФ) родопсин остается в Гольджи (G) в течение in vitro погони, что указывает на то, что анализ является АТФ-зависимым (2). После добавления АТФ (+ АТФ) радиоактивно меченный родопсин выходит из Гольджи и появляется в TGN и в пост-Гольджи-фракциях низкой плотности (PG).Распределение мембран Гольджи и TGN определялось их галактозилтрансферазной или сиалилтрансферазной активностями соответственно (1, 2, 14). Указаны активности объединенных мембранных фракций. Распределение активности трансфераз не зависит от содержания родопсина и не зависит от почкования мембран после Гольджи (2).
Синтетический пептид, соответствующий С-концу родопсина, ингибирует его перемещение после Гольджи в бесклеточной системе.
Пост-Гольджи транспорт в бесклеточной системе сетчатки лягушки ингибируется анти-родопсиновым mAb 11D5 или его Fab-фрагментами, а родопсин задерживается в компартменте, идентифицированном по его сиалилтрансферазной активности как TGN (2). Антигенный эпитоп ингибирующего mAb 11D5 был картирован в пределах девяти аминокислот, составляющих С-конец родопсина (1). Фиг. 2 схематически представляет трансмембранную модель родопсина, показывающую антигенный сайт mAb 11D5 и расположение мутаций в С-концевом домене, идентифицированных у пациентов с ADRP.Поскольку ингибирующее анти-С-концевое антитело также может взаимодействовать с соседними областями, мы хотели проверить, содержит ли С-концевой домен родопсина сигнал, который регулирует его передачу. Чтобы изучить роль C-концевого домена, мы синтезировали несколько пептидов, соответствующих цитоплазматическим или интрадискальным доменам родопсина (как показано на рис. 2), и протестировали их влияние на доставку родопсина in vitro .
Рисунок 2Модель родопсина, показывающая местоположения мутаций ADRP в С-концевом домене, антигенном сайте mAb 11D5, а также местоположения и последовательности пептидов, используемых в этом исследовании.( A ) Пептиды, синтезированные для этого исследования, выделены серым цветом. L1-L4 — это петли цитоплазмы. С-концевые аминокислоты, мутировавшие при пигментном ретините, показаны черным цветом. Мутации, смоделированные в этом исследовании, обозначены *. ( B ) Последовательности С-концевых пептидов родопсина лягушки и крупного рогатого скота, использованные в этом исследовании. Поскольку родопсин лягушки содержит две (одна и пять аминокислот) вставки в этой области, они представлены пунктирной линией в последовательности бычьего пептида и пунктирными светлыми кружками на модели.
На упорядоченное прохождение радиоактивно меченного родопсина через биосинтетический компартмент во время бесклеточной погони значительно повлияло добавление 50 мкМ C-концевого пептида лягушки (аминокислоты 330–354) (рис. 3 A ). Недавно синтезированный родопсин был преимущественно связан с мембранами, идентифицированными по их сиалилтрансферазной активности как TGN, и его появление в пост-Гольджи-мембранах уменьшилось на 60%. Это ингибирование зависело от концентрации, поскольку 25 мкМ пептид ингибировал транспорт после Гольджи на 47% в той же серии экспериментов (данные не показаны).Распределение радиоактивно меченного родопсина очень напоминало его ранее описанное распределение в присутствии mAb 11D5 (2), что указывает на общий механизм ингибирования на уровне TGN. Этот результат значительно отличается от ранее описанного распределения родопсина в присутствии кроличьего GDI (2). Ингибирование трафика Rab GDI почти идентично таковому в отсутствие ATP и отражает раннее и полное блокирование трафика во всех компартментах во время in vitro преследования.Напротив, в присутствии С-концевого пептида родопсина первоначально происходил некоторый перенос родопсина, и примерно 25% радиоактивно меченного родопсина перераспределялось из ER и Гольджи в конце периода преследования. Скорость выведения из этих компартментов была сопоставима с контролем с АТФ. Это открытие предполагает, что на транспорт родопсина на уровне ER и Golgi не влияет C-концевой пептид и что его ингибирующий эффект проявляется, когда родопсин достигает TGN.
Рисунок 3Ингибирование переноса родопсина после Гольджи с помощью C-концевых синтетических пептидов в бесклеточной системе сетчатки лягушки. ( A ) Радиомеченый ПНС сетчатки лягушки предварительно инкубировали с С-концевым пептидом родопсина 330–354 лягушки перед бесклеточным преследованием в присутствии АТФ. Распределение радиоактивно меченного родопсина измеряли в PhosphorImager в девяти (контроль, + АТФ и пептид) или трех (контроль, -АТФ) экспериментах. Данные представлены в виде среднего значения ± SE. В контрольном образце без добавления пептида (контроль, + АТФ) в дополнение к мембранам после Гольджи, уже образовавшимся в изолированных сетчатках во время импульса (≈15%) (2), дополнительные ≈16% от общего количества радиоактивно меченного родопсина накапливаются во фракции мембран после Гольджи (пул фракции 2) во время бесклеточной погони.Истощение АТФ (-АТФ) полностью ингибирует дополнительное образование мембран после Гольджи во время погони (2). В отсутствие АТФ дальнейший транспорт не происходит, поэтому остаточные уровни радиоактивно меченного родопсина во фракции после Гольджи обусловлены перемещением, которое произошло в живых сетчатках до бесклеточного преследования. АТФ-зависимое появление родопсина в пост-Гольджи-мембранах во время погони подавляется на 60% в присутствии 50 мкМ С-концевого пептида, и родопсин задерживается в TGN.В этих условиях С-концевой пептид, по оценкам, находится в 100-кратном избытке по сравнению с родопсином. Ингибирование движения родопсина оценивается на фоне -АТФ; ордината справа относится только к АТФ-зависимому появлению родопсина во фракции мембран после Гольджи, если вычесть этот фон. ( B ) Ингибирование пост-Гольджи-трафика (≈50%) и распределение радиоактивно меченного родопсина было почти идентичным для двух тестируемых бычьих пептидов (25-мерного и 19-мерного).Пептид, соответствующий С-концевым 19 аминокислотам бычьего родопсина, полностью сохраняет ингибирующий эффект на транспорт родопсина. Данные представлены как средние значения ± стандартная ошибка трех отдельных экспериментов.
Пост-Гольджи незаконный оборот родопсина лягушки также ингибируется бычьими С-концевыми пептидами.
Поскольку C-концевой домен высоко консервативен среди видов родопсина (25), мы протестировали эффект бычьего пептида (аминокислоты 324–348) на перенос родопсина в системе сетчатки лягушки.Сравнение С-концевой последовательности лягушки и быка показано на рис. 2. При одинаковой концентрации (50 мкМ) бычий пептид ингибировал трафик после Гольджи на ≈50%, а радиоактивно меченый родопсин накапливался преимущественно в легкой фракции TGN ( пул фракции 3) (рис.3 B ). Этот компартмент богат малым GTPase rab6 (он содержит почти 30% всего мембраносвязанного rab6), но имеет более низкую сиалилтрансферазную активность, чем мембраны TGN, которые осаждаются во фракционном пуле 4 (см.рис.1) (14).
Более короткий бычий С-концевой пептид (аминокислоты 330–348) ингибировал трафик после Гольджи в той же степени, что и более длинный, что позволяет предположить, что аминокислоты 324–330 не участвуют в этом распознавании (шесть из семи этих аминокислотных остатков). кислоты идентичны в последовательности лягушки и крупного рогатого скота с одной консервативной заменой). Эти аминокислоты также отсутствуют в C-концевом пептиде лягушки, который ингибирует доставку родопсина (см. Рис. 2). Первичные последовательности родопсина лягушки и крупного рогатого скота в С-концевом домене очень гомологичны, но родопсин лягушки содержит две вставки (одна и пять аминокислот) (21) (см.рис.2). Трехмерная структура С-концевого домена крупного рогатого скота была определена с помощью ЯМР (26, 27). Сравнение последовательности лягушки и быка позволяет предположить, что если пептид лягушки принимает аналогичную конформацию, консервативные аминокислоты группируются на одной стороне этого домена.
Пептиды, соответствующие цитоплазматическим петлям родопсина, не влияют на его распространение.
Поскольку C-конец включает только часть цитоплазматической поверхности родопсина, мы хотели проверить, вносят ли соседние цитоплазматические петли вклад в сигнал сортировки.Добавление пептида, соответствующего третьей цитоплазматической петле (аминокислоты 234–245) или более длинного пептида (аминокислоты 231–252), которые, как известно, содержат сайты взаимодействия с трансдуцином (28), аррестином (29) и родопсинкиназой ( 30), не влияли на трафик после Гольджи (30,6 ± 0,9% общего радиоактивно меченного родопсина в мембранной фракции после Гольджи в контроле против 30,6 ± 2,1% в присутствии пептида 234–245, четыре отдельных эксперимента). Несколько других пептидов, включая вторую цитоплазматическую петлю (аминокислоты 141–153) и контрольный N-концевой (интрадискальный) домен (аминокислоты 3–14), также не оказали влияния (данные не показаны).Пептиды, соответствующие первой (аминокислоты 63–75) и четвертой петле (аминокислоты 310–321), показали минимальное ингибирование (≈20%). Поскольку эти петли находятся в непосредственной близости к C-концевому домену в трехмерной структуре (31), возможно, что они вносят некоторый вклад в сайт узнавания. Однако последние 24 C-концевые аминокислоты родопсина лягушки (или последние 19 аминокислот родопсина крупного рогатого скота) составляют основную часть домена, ответственного за его сортировку.
Удаление QVSPA из ингибирующего С-концевого пептида устраняет его влияние на торговлю родопсином.
Пять аминокислот QVS (A) PA являются наиболее консервативными в С-концевом домене. Чтобы проверить важность этих аминокислот, мы смоделировали естественную мутацию стоп-кодона, которая удаляет последние пять аминокислот родопсина Q344ter (32, 33). Мы синтезировали усеченный C-концевой пептид лягушки (аминокислоты 330–349) и проследили его влияние на перенос родопсина после Гольджи. Как показано на фиг.4 A и B , делеция QVSPA из ингибирующего С-концевого пептида устраняет его влияние на транспорт родопсина (23.8 ± 1,3% радиоактивно меченного родопсина во фракции мембран после Гольджи в присутствии С-концевого пептида против 34,4 ± 1,6% в присутствии усеченного пептида, P = 1,8 × 10 — 3 , контроль = 32,0 ± 1,7%, три отдельных эксперимента). Субклеточное распределение радиоактивно меченного родопсина полностью соответствовало его распределению в контроле. Подобный усеченный С-концевой пептид крупного рогатого скота (аминокислоты 331–342) не оказывал значительного влияния на транспорт родопсина (данные не показаны).Это открытие предполагает, что С-концевые пептиды, лишенные аминокислот QVS (A) PA, не могут успешно конкурировать с родопсином за связывание со специфическим фактором (факторами) распознавания и, следовательно, не могут влиять на его внутриклеточный транспорт.
Рисунок 4 МутацииADRP Q344ter (без аминокислот QVAPA), V345M и P347S, введенные в С-концевой пептид лягушки, устраняют его ингибирующее действие на транспорт родопсина. ( A ) Авторадиограммы SDS / PAGE, показывающие субклеточное распределение радиоактивно меченного родопсина после преследования в контроле с АТФ (контроль, + АТФ) в присутствии 50 мкМ С-концевого пептида лягушки (пептид 330–354), и в присутствии 50 мкМ усеченного С-концевого пептида лягушки (пептид 330–349).Родопсин с радиоактивной меткой выглядит в этом геле в виде дублета. Однако обе формы мигрируют быстрее, чем необработанный родопсин, присутствующий в ER (данные не показаны и ссылка 1). Возможно, что две обнаруженные формы разрешаются на основе дифференциального гликозилирования в Golgi и / или TGN, но происхождение этих различий в настоящее время неизвестно. Важно отметить, что обе эти формы обнаруживаются во фракции после Гольджи (пул фракции 2) в контроле и доставляются в ROS in vivo (не показано).( B ) Распределение меченного радиоактивным изотопом родопсина, измеренное с помощью PhosphorImager в трех отдельных экспериментах и представленное как среднее ± стандартная ошибка. Усечение последних пяти аминокислот снижает ингибирующий эффект С-концевого пептида. ( C ) Распределение радиоактивно меченного родопсина измеряли в четырех отдельных экспериментах. Замена аминокислоты V351M (-3 от С-конца) или P353S (-1) устраняет ингибирующий эффект С-концевого пептида. Остальные детали такие, как на фиг.1 и 3.
Замены, имитирующие мутации ADRP V345M и P347S, полностью устраняют ингибирующую активность С-концевого пептида.
Для дальнейшего определения аминокислот, критических для распознавания С-концевой последовательности родопсина, мы синтезировали два пептида, соответствующие аминокислотам 330–354 родопсина лягушки с одиночными аминокислотными заменами V351M и P353S. Эти замены соответствуют мутациям V345M и P347S, обнаруженным у пациентов с ADRP (34–36).Добавление этих пептидов в бесклеточную систему не влияло на транспорт родопсина, в то время как в той же серии экспериментов родительский пептид 330–354 уменьшал его выход из TGN на 60% (рис. 4 C ). Пептид-зависимое ингибирование не было полным в наших экспериментах, но наличие консервативных последних пяти аминокислот родопсина было критическим для ингибирующей активности. В совокупности наши данные предполагают, что последние пять аминокислот родопсина содержат сигнал, который специфически распознается в TGN.Аминокислоты валин (-3 от С-конца) и пролин (-1) абсолютно необходимы для распознавания сигнала, в то время как серин (-2) может быть заменен аланином, что подтверждается успешной конкуренцией бычьего пептида с родопсином лягушки.
ОБСУЖДЕНИЕ
Родопсин через свой цитоплазматический домен взаимодействует с рядом цитозольных белков. Многие из этих взаимодействий приводят к активации и дезактивации ферментативного каскада, запускаемого светом (5).Интересно, что одна из наиболее консервативных областей цитоплазматического С-конца родопсина, QVAPA (QVSPA у лягушек, рыб и миног), по-видимому, не участвует в таких светозависимых функциях (13, 22). Тем не менее, этот высококонсервативный домен очень важен, поскольку мутации в этих аминокислотах вызывают тяжелые формы ADRP (19, 20, 37). Ранее мы показали, что mAb с антигенным сайтом в пределах девяти аминокислот на С-конце родопсина ингибирует его перенос в бесклеточную систему сетчатки лягушки (2).Это первоначальное наблюдение подсказало нам, что часть сигнала, отвечающая за поляризованную сортировку родопсина в фоторецепторных клетках, может находиться в этом домене. Независимые наблюдения нескольких групп, изучающих мутации, которые, как известно, вызывают ADRP у трансгенных животных, подтверждают эту возможность. Мыши, экспрессирующие трансген Q344ter (отсутствующие аминокислоты QVAPA), демонстрируют почти нормальный световой ответ, но накапливают усеченный родопсин в плазматической мембране внутренних сегментов фоторецепторов (13). Аномальное накопление внеклеточных мембран, содержащих родопсин, наблюдалось у мышей, несущих мутацию пролин 347 — серин (P347S) (10).Исследования на трансгенных животных предполагают, что транспорт родопсина может быть дефектным, но не определили конкретную стадию, на которую влияют мутации.
В настоящем исследовании мы определили С-конец родопсина как домен, который регулирует его TGN для трафика после Гольджи. Мы использовали анализ in vitro , который воссоздает трафик внутри Гольджи, а также образование мембран после Гольджи из TGN (2). Распределение биосинтетических мембран и субклеточных органелл в этой системе ранее было определено комбинацией морфологических и биохимических подходов (1, 2, 14, 16, 17).Используя эту систему, мы выбрали синтетические пептиды для дальнейшего изучения роли цитоплазматического домена родопсина. Большинство пептидов, которые мы протестировали в этом анализе, успешно использовались в других исследованиях, определяющих функциональные домены родопсина (28, 38). Это высокополярные водорастворимые пептиды, которые могут принимать правильную конформацию в растворе и действовать как конкурентные ингибиторы физиологических процессов с участием родопсина (28, 38). Более того, анализ ЯМР бычьего С-концевого пептида выявил компактную глобулярную структуру, потенциально включающую отдельный домен родопсина (26, 27).С-концевые пептиды лягушки и быка задерживают родопсин в TGN. Они не оказали значительного влияния на транзит родопсина через другие компартменты, различимые в этой системе, что позволяет предположить, что структура и функция этих компартментов не были затронуты пептидами. Это открытие важно, потому что некоторые пептиды способны принимать конформацию, которая увеличивает их сродство к мембранам и неспецифическим образом ингибирует внутриклеточный трафик (39). По-видимому, это не относится к С-концевым пептидам родопсина.
Ингибиторные С-концевые пептиды не препятствовали выходу вновь синтезированного родопсина из ER или его прохождению через комплекс Гольджи в бесклеточной системе сетчатки лягушки. В присутствии пептида фракции, обогащенные как Гольджи, так и ER, имели содержание вновь синтезированного родопсина, почти идентичное таковому в контроле с АТФ. Необработанная форма родопсина с более медленной электрофоретической подвижностью ранее была обнаружена в связи с ER в необработанных клетках или локализована в слитом компартменте Golgi-ER после кратковременной обработки брефельдином (1).Этот предшественник родопсина, специфичный для ранних биосинтетических компартментов, не был обнаружен в наших экспериментах по ингибированию с пептидами. Вместо этого процессированный родопсин был обнаружен во фракциях, обогащенных мембранами TGN (см. Рис. 4 A ). Это указывает на то, что распознавание С-концевой последовательности происходит в TGN, за компартментами ER и Golgi и до образования пост-Golgi мембран. Добавление С-концевых пептидов мешает этим процессам, скорее всего, конкурируя за факторы сортировки и влияя на скорость выхода родопсина из TGN.
Наиболее важным открытием, о котором здесь сообщается, является то, что С-концевая последовательность QVS (A) PA, по-видимому, является критической для регуляторной функции этого домена. Пептиды, лишенные этой последовательности или содержащие отдельные аминокислотные замены, не ингибируют перенос родопсина после Гольджи. Это указывает на то, что предполагаемый фактор (ы) распознавания может связываться непосредственно с С-концевой последовательностью, когда родопсин появляется в TGN, хотя другие домены родопсина также могут вносить вклад в общую аффинность связывания.Наиболее частые мутации ADRP в С-концевом домене включают замены пролина 347 (эквивалент 353 у лягушки), где были идентифицированы шесть различных миссенс-мутаций в этом положении (37). Этот предпоследний пролин может иметь решающее значение для позиционирования последней аминокислоты, которая неизменно является аланином, для связывания в гидрофобном кармане предполагаемого взаимодействующего белка, участвующего в событиях сортировки. Гидрофобные карманы, которые селективно распознают консенсусную последовательность из четырех остатков (XT / SXV-COO —) мембранных белков, недавно были описаны в семействе белков, содержащих домен PDZ, которые группируют мембранные рецепторы и сигнальные молекулы в определенных субклеточных клетках. сайты (40, 41), а также могут регулировать их субклеточное нацеливание (42).Белок домена PDZ Drosophila , InaD, организует родопсин Rh2 с множеством компонентов каскада фототрансдукции в сигнальный комплекс, и мутация в одном из его доменов PDZ вызывает дегенерацию сетчатки (43, 44). Белок с PDZ-подобными или другими доменами узнавания может регулировать сортировку родопсина в фоторецепторных клетках позвоночных или может быть важен для привлечения других компонентов каскада зрительной трансдукции, таких как трансдуцин и цГМФ-фосфодиэстераза, в несущие родопсин пост-Гольджи-мембраны, как это было раньше. локализованы на этих мембранах в фоторецепторах лягушек (1).
Мембраны пост-Гольджи, несущие родопсин, не содержат клатрина и не имеют морфологически различимой оболочки (1, 4). Однако неклатриновая оболочка могла участвовать на некоторых стадиях их формирования. В общем, перенос через мембрану из ER и внутри комплекса Гольджи регулируется неклатрин-ассоциированными белковыми комплексами COPI и COPII, которые взаимодействуют со специфическими сигналами сортировки в молекулах груза (45). Поскольку в настоящее время почти ничего не известно о белках оболочки, не связанных с клатрином, которые регулируют трафик после Гольджи, белках COP, похожей на кружево оболочке, которая, как было обнаружено под микроскопом, связана с TGN клеток NRK (46), и недавно описанном TGN-ассоциированном связанный с адаптером белковый комплекс AP3 с нейрон-специфическими изоформами (47, 48), являются потенциальными кандидатами, которые могут играть роль в сортировке белков в компартменте, релевантном для транспортировки родопсина.
Хотя идентификация белков, которые распознают последовательность QVS (A) PA родопсина, остается задачей будущего, усугубляемой нынешней нехваткой информации о роли белков неклатриновой оболочки в трафике после Гольджи, мы предполагаем, что поляризованные сортировка родопсина на выходе из TGN опосредуется взаимодействием C-концевой последовательности QVS (A) PA с белком оболочки, который может содержать PDZ-подобный или другой домен узнавания. Такая белковая оболочка может позволить молекулам родопсина проникать в специфических носителей после Гольджи.Хотя точные взаимодействия, лежащие в основе этих явлений, еще предстоит очертить, данные, представленные в этой работе, различают несколько моделей, включая потенциальные события выше и ниже по течению от конкретных процессов сортировки, описанных здесь, которые были предложены для объяснения эффектов мутаций в C конец родопсина. Основываясь на представленных результатах, мутации, исследованные в этой и других работах (10, 13), скорее всего, мешают правильной сортировке родопсина и приводят к аномальному образованию мембран после Гольджи.
Благодарности
Мы благодарны доктору Дэвиду Пейпермастеру за его постоянную поддержку, вдумчивые обсуждения и критическое прочтение рукописи. Мы благодарим Белен Пулео-Шеппке и Клаудию Триппе за их неоценимую помощь на начальных этапах этого проекта. Эта работа была поддержана грантом Национального института здравоохранения EY-6891 и основным грантом на исследования зрения EY-07003 (D.D.) и EY-6226, а также неограниченной ведомственной наградой от Research to Prevent of Blindness (P.А.Х.).
Сноски
↵ ‡ Кому запросы на перепечатку следует направлять по адресу: Kellogg Eye Center, Мичиганский университет, 1000 Wall Street, Ann Arbor, MI 48105. Электронная почта: dereticd {at} umich.edu.
СОКРАЩЕНИЯ
- ROS,
- стержень (сегменты) наружный;
- TGN,
- сеть транс-Гольджи;
- PNS,
- постнуклеарный супернатант;
- ADRP,
- аутосомно-доминантный пигментный ретинит;
- ER,
- эндоплазматический ретикулум
- Поступила 17 марта 1998 г.
- Принято 14 июля 1998 г.
- Авторские права © 1998, Национальная академия наук
GingerBridge 2020 празднует 6 лет веселья с выпечкой |
GingerBridge 2020 празднует 6 лет выпечки
Наш 6 -й Ежегодный конкурс имбирных пряников — GingerBridge 2020 — показал, что наши команды пекут, строят и представляют дома. В этом году к нам присоединилась выдающаяся коллегия судей из AECOM, Corgan Architects, IBI Group, Geosyntec Consultants и Synchronis Architecture.Все сотрудники KPFF выражают огромную благодарность этим замечательным волонтерам, которые потратили свое время, чтобы присоединиться к нам, чтобы весело провести время и весело провести время. Чтобы посмотреть полное видео, посетите нашу страницу в Facebook @kpffla.
В этом году мы хотели уделить немного времени, чтобы поразмыслить над тем, как все это началось. Много лет назад одному из наших сотрудников пришла в голову блестящая идея начать серию лекций, чтобы познакомить наших инженеров с историей архитектуры. Эта серия статей была посвящена основным направлениям архитектуры, чтобы помочь нам лучше понять наших клиентов и их дизайнерские цели.После того, как мы завершили наш первый год семинаров, у нас возникла идея создать конкурс, где структурное проектирование имбирных пряников могло бы быть основано на том, что инженеры узнали на своих уроках истории архитектуры. Мы пригласили группу выдающихся судей присоединиться к нам и выбрать победителя главного приза на основе архитектурных достоинств, а также второй награды за выдающуюся презентацию.
Последняя награда в нашем трио основана на структурной целостности имбирных пряников в рамках теста на встряхивающем столе.Первоначально победителем этого приза объявлялась структура, продержавшаяся дольше всех на столе. Шли годы, и наши пекари становились все лучше и лучше. Их понимание материала и характеристик имбирных пряников и различных форм съедобного клея, таких как глазурь, зефир, угощения с рисом Криспи и леденцов, и их ограничения стали глубже. Таким образом, уровень сложности дизайна и структурной целостности вырос в соответствии с нашим новым пониманием материальности, а также углубленными обсуждениями, сфокусированными на темах в архитектуре.Например, в прошлом году была битва между священным и мирским, воплощенная церквями и стадионами. Каждой команде приходилось выбирать между постройкой сооружения для поклонения или спорта. Большинство команд предпочитают строить стадионы под открытым небом, сломать которые оказалось невозможно. Несмотря на то, что наш встряхивающий стол каждый год совершенствуется, в прошлом году монолитные арены не сдавались. Зрителей и судей ждало большое разочарование. Что такое испытание на встряхивающем столе без массового разрушения?
Наши докладчики с каждым годом становятся все сложнее.Продемонстрированные навыки с тщательно продуманными костюмами, декорациями, песнями и рассказами со временем превратились в большие постановки. Мы обнаружили в нашей группе так много скрытых талантов благодаря этим песням и танцам, изобретательным предысториям и одноактным пьесам. Мы с нетерпением ждем этих забавных, а иногда и трогательных моментов каждый год — почти так же, как смотреть, как разваливаются пряники.
В 2020 году мы столкнулись со многими препятствиями и проблемами в нашем офисе, по всей стране и по всему миру.Как рабочая семья, мы хотели быть уверены, что можем приобщиться к тому, что мы все любим и любим: наша ежегодная традиция пряников. Однако строить структуры в командах было проблематично, а единый стол встряхивания был невозможен. Просить всех собраться в офисе, чтобы посмотреть на разрушения, не казалось хорошей идеей. Таким образом, команде Gingerbread нужно было придумать способ единообразно разрушить структуру и представить ее коллегии судей, избегая технических проблем, которые часто мешают онлайн-встречам.Вот наш руководитель структурных подразделений в Лос-Анджелесе Аарон Рейнольдс, которому пришла в голову блестящая идея загружать пряничные мосты консервными банками.
Чтобы отметить нашу практику расширения мостов, мы узнали об истории мостов и некоторых основах их конструкции. Затем были сформированы команды. Каждый мог испечь индивидуально, с семьей или в безопасной команде. Каждый мост был построен и затем заснят, пока соответствующие команды загружали банки до тех пор, пока они не рухнули — а они должны рухнуть. Частью забавы является неожиданный момент, когда имбирь трескается, и леденцы разлетаются во все стороны.Мы обеспечили разрушение конструкции со значительными штрафами за неразрушаемые мосты. Затем мы все собрались за обедом, чтобы посмотреть, как эти красочные, веселые и красивые мосты разрушаются под тяжестью содовой и зеленой фасоли. Это было потрясающе!
Хотя мы не знаем, сможем ли мы снова собраться в декабре 2021 года, мы точно знаем, что непоколебимый дух наших пекарей продолжает жить. Мы желаем вам удачи в Новом году и с нетерпением ждем новых имбирных перерывов.
«Назад к новостямКупить дешево FantasyDynasty: Le château DERETIC cd key
GG.deal объединяет игровые ключи из более чем 40 магазинов цифровой дистрибуции, поэтому вы можете найти лучшие предложения по видеоиграм . Все предложения уже включают скидки от ваучеров, чтобы сэкономить ваше время и деньги. Проверьте историю цен игры, чтобы определить, насколько выгодна сделка по сравнению с исторически низкими предложениями. Если цена по-прежнему слишком высока, создайте уведомление о цене и получите уведомление по электронной почте, когда FantasyDynasty: Le château DERETIC будет соответствовать вашему бюджету!
Активируется ли цифровой ключ FantasyDynasty: Le château DERETIC в моем регионе?
Мы всегда стараемся, чтобы цена, отображаемая в нашем сравнении, была назначена правильным регионам.Однако некоторые магазины не сообщают информацию о региональных блокировках в своих фидах товаров, и это может приводить к очень редким ошибкам. Перед тем как купить FantasyDynasty: Le château DERETIC, пожалуйста, проверьте страницу магазина, чтобы узнать об ограничениях на активацию в вашем регионе. Если вы заметили какой-либо продукт, относящийся к неправильному региону на GG.deals, , свяжитесь с нами , и мы исправим список как можно скорее.
Смогу ли я сразу загрузить игру FantasyDynasty: Le château DERETIC?Все магазины, представленные на GG.Сделки доставят вашу игру сразу после подтверждения оплаты. Это будет либо прямая загрузка, либо ключ ПК — в зависимости от выбранного вами магазина. После активации ключа на соответствующей платформе вы сможете бесплатно скачать и играть в свою игру. Если вы не знаете, как активировать ключ, ознакомьтесь с разделом руководств внизу страницы.
Иногда некоторые магазины могут задерживать покупку для просмотра вашего заказа вручную.Эти проверки предназначены для предотвращения мошенничества в магазине. Если ваш заказ выбран для ручной проверки, и вы не хотите ждать или предоставлять дополнительную информацию, вы всегда можете запросить отмену заказа и вернуть свои деньги.
Могу ли я получить бесплатный ключ Steam FantasyDynasty: Le château DERETIC? Есть ли способ скачать FantasyDynasty: Le château DERETIC бесплатно?Если у вас мало денег и вы хотите получить FantasyDynasty: Le château DERETIC бесплатно, есть несколько способов попробовать:
- Вы можете создать ценовое оповещение на GG.сделок и установите цену « бесплатно ». Такие магазины, как Humble Bundle или Indie Gala, часто раздают бесплатные ключи Steam в рекламных целях. В Epic Games Store также регулярно проводятся розыгрыши призов. Если есть способ получить FantasyDynasty: Le château DERETIC бесплатно, вы узнаете об этом первым!
- GG.deals иногда организует розыгрыш призов , где вы можете выиграть хорошие игры за выполнение коротких заданий. Следите за этими розыгрышами и активно участвуйте, чтобы повысить шансы на выигрыш приза!
Даже если бесплатная загрузка FantasyDynasty: Le château DERETIC недоступна, вы всегда можете сэкономить и получить ключ по самой низкой цене с помощью GG.двигатель сравнения сделок.
Какой магазин FantasyDynasty: Le château DERETIC выбрать? В чем разница между официальными магазинами и магазинами ключей?
Цена — не единственный критерий, который следует учитывать при покупке компьютерных игр через GG.deals.
- При просмотре предложений для FantasyDynasty: Le château DERETIC убедитесь, что ключ активирован через DRM по вашему выбору. Вы найдете эту информацию на игровой карте в виде значка запуска.Например, если вы хотите, чтобы получил FantasyDynasty: Le château DERETIC Steam key и активировал его в Steam, выберите магазин, у которого есть значок Steam.
- Выбирайте между официальными магазинами и магазинами ключей. Официальные магазины продают ключи к играм в розницу, получая их напрямую через разработчика или издателя игры. Магазины ключей перепродают ключи от игр из неизвестных источников. Цены в магазинах с ключами часто ниже, чем в официальных магазинах, но здесь есть определенные риски, и покупка через неавторизованных реселлеров не окажет прямой поддержки разработчикам игр.
Азитромицин и ципрофлоксацин оказывают хлорохиноподобное действие на клетки респираторного эпителия
Введение
Коронавирусы (CoV) — это семейство вирусов, вызывающих заболевания у людей и животных, включая 4 эндемичных CoV человека (HCoV-NL63, HCoV- OC43, HCoV-229E и HCoV-HKU1), вызывающие легкие инфекции дыхательных путей категории простуды 1 . Продолжающаяся и бушующая пандемия серьезных респираторных заболеваний 2019-2020 гг., Вызванная новым коронавирусом 2,3 , была предвосхищена двумя известными предшествующими эпидемиями: в 2002-2004 гг. Тяжелым острым респираторным синдромом (SARS), вызванным коронавирусом SARS (SARS-CoV). ; 8096 случаев заражения в 26 странах, 774 случая смерти) 4 ; и, в 2015 году, ближневосточный респираторный синдром (MERS), вызванный коронавирусом MERS (MERS-CoV; 2494 случая в 27 странах, 858 смертей) 5 , все они демонстрируют высокую смертность, с высокой распространенностью острого респираторного дистресс-синдрома (ARDS). ), аритмия и смерть, а в разрешенных случаях — долгосрочное снижение функции легких и инвалидность.В настоящее время нет одобренных лекарств или вакцин от коронавирусных заболеваний.
Новый вирус, подобный SARS-CoV, 2019-nCoV (CoV2), связанный с SARS-CoV, но отличающийся от него, был идентифицирован как возбудитель текущей вспышки вирусной пневмонии 2019-2020 годов, которая началась в Ухане, США. Китай, распространившийся на все постоянно заселенные континенты. Распространение CoV2 от человека к человеку привело к безудержной глобальной пандемии, вызвавшей заболевание, названное Всемирной организацией здравоохранения COVID-19 (коронавирусная болезнь-2019).Пандемии COVID-19 нарастают тревожными темпами: на момент написания статьи 649 904 инфицированных и 15 835 смертей только в Италии и Испании с совокупным уровнем смертности 9,6% в этих непропорционально пораженных странах, удаленных от эпицентра первоначальной эпидемии 6, 7 . COVID-19 угрожает населению всего мира из-за пагубного сочетания длительного инкубационного периода в сочетании с исключительным потенциалом распространения и значительно высокой заболеваемости и смертности. Репродуктивное число R 0 первоначально оценивалось как 2.2-2,7 8,9 по некоторым оценкам может достигать 4,7-6,6 10 . Общественному здравоохранению необходимо срочно понять CoV2 как вирус, COVID-19 как болезнь и COVID-19 как пугающее эпидемиологическое явление. Мир буквально изо всех сил пытается разработать контрмеры, в том числе терапевтические, направленные на уменьшение тяжести болезни и разработать профилактику, включая вакцины. Недавно два одобренных FDA препарата, хлорохин (CQ) и азитромицин (AZT), продемонстрировали терапевтический эффект при COVID-19, используя вирусную нагрузку в качестве конечных точек в сострадательном использовании / начальных клинических испытаниях, связанных с опасными для жизни легочными осложнениями 11 .
Эта работа началась в то время, когда был достигнут значительный прогресс в понимании ключевых свойств аномальной ионной проводимости в респираторном эпителии при муковисцидозе (CF), с дефектами транспорта хлоридов через регулятор трансмембранной проводимости при муковисцидозе CFTR и Транспорт натрия по эпителиальному натриевому каналу ENaC 12 . Определенные лекарственные препараты доказали свою эффективность при лечении легочных заболеваний при CF, такие как AZT, антибиотик, который является основным продуктом клинического лечения CF 13,14 .Пациенты с МВ, получавшие зидовудин 14 по нескольким аспектам функции легких, снизили частоту обострений и улучшили качество жизни 15–19 , хотя величина этих преимуществ может варьироваться 20 . В качестве антибиотика можно ожидать, что механизм действия AZT при CF будет убивать бактерии, однако уровни этого макролида в тканях не достигают необходимых антипсевдомональных концентраций в легких, чтобы можно было легко объяснить его преимущества.В то время как несколько исследований предполагают влияние AZT на бактериальные биопленки 21 , есть убедительные доказательства того, что опосредованные хозяином эффекты этого макролида столь же важны, поскольку: (i) AZT оказывает благоприятное воздействие на CF, даже до 19 Pseudomonas aeruginosa происходит колонизация 22 ; и (ii) AZT защищает эпителий бронхов во время инфекции P. aeruginosa независимо от его антимикробной активности 23 . Таким образом, АЗТ дает ранее неопределенное и независимое от антибиотиков преимущество, которое документально подтверждено в клинических исследованиях МВ 15–19 и обычно наблюдается при лечении МВ.Однако последующее исследование сделало предостережение в отношении длительного использования AZT при МВ, поскольку он, как и хлорохин, подавляет аутофагию 24 , которая участвует в борьбе с микобактериями 25 .
Здесь мы сообщаем, что зидовудин и ципрофлоксацин (CPX), как было ранее продемонстрировано для хлорохина 26 , изменяют pH во внутриклеточных органеллах в респираторных эпителиальных клетках, и что эта коррекция приводит к нормализации клеточно-автономного иммунитета. функции респираторного эпителия при МВ.Этот эффект может быть достигнут с помощью разнообразного набора одобренных FDA препаратов 26–31 . Наши данные показывают, что действие AZT по крайней мере частично совпадает с механизмом действия CQ. Кроме того, мы предлагаем, чтобы клинические испытания с пациентами с риском развития тяжелой формы COVID-19, в которых планируются препараты с нейтрализующим действием, такие как хлорохин, основывались на рассмотрении CPX,
Результаты и обсуждение
Азитромицин корректирует рН органелл в эпителиальных клетках легких при МВ
Мы протестировали действие AZT на респираторные эпителиальные клетки МВ в отсутствие бактерий или агонистов микробного врожденного иммунитета.Среди используемых тестов мы изучаем pH внутриклеточных органелл, поскольку предыдущие исследования 27–29,32–35 показали, что эти органеллы демонстрируют слегка повышенное закисление в респираторных эпителиальных клетках МВ. Что еще более важно, в отличие от большинства других макролидов, которые проявляют небольшую пользу в CF 14 , AZT обладает двумя слабыми основными функциональными группами с pK a , равным 8,2 и 8,6 (рис. 1A). PH просвета транс- сети Гольджи (TGN) и рециклирующих эндосом (RE) в клетках легких при CF измеряли с помощью ратиометрического применения внутриклеточного pH-чувствительного зонда, pHlourin GFP 36 .PH-чувствительный GFP был слит с TGN38 или целлубревином, таким образом локализуя pHluorin GFP в просвете TGN или RE 36 в клетках респираторного эпителия CF 35,34 . Первичные эпителиальные клетки бронхов при МВ, обработанные зидовудином, показали коррекцию ранее описанной гиперацидификации TGN и RE 27–29,32–35 (рис. B-G). Обработка IB3-1 (клетки CF) либо 100 мкМ (в течение 1 часа), либо 1 мкМ AZT (в течение 48 часов) приводила к корректировке pH TGN с 6,2 ± 0,1 (контроль) до 7.1 ± 0,1 или до 6,7 ± 0,2 (рис. 1C), что сопоставимо с pH 6,7 ± 0,1 в TGN клеток S9 (клетки IB3-1 с поправкой на CFTR). В первичных бронхиальных эпителиальных клетках МВ (рис. 1D) лечение AZT скорректировало их pH TGN с 6,1 ± 0,2 до 6,7 ± 0,1 (рис. 1D). Следует отметить, что абсолютная концентрация AZT не была критической для эффекта при равновесии, как и ожидалось от внеклеточного стока ацидотропного агента, накапливающегося в подкисленных компартментах, протонируясь и захватывая просвет органелл.
Рис. 1. AZT корректирует pH в просвете внутриклеточных органелл эпителиальных клеток легких при МВ.A. Химическая формула AZT и pK его аминогрупп. Б-Г. Муковисцидоз (IB3-1 или первичные эпителиальные клетки бронхов из трансплантатов легких CF) и нормальные (S9, клетки IB3-1 с коррекцией CFTR) трансфицировали либо TGN38-GFP pHluorin (BD), либо целлубревином-GFP pHluorin (EG) и pH TGN (BD) или рециркулирующей эндосомы (EG) определяли ратиометрически (интенсивность излучения при 508 нм при возбуждении на 410 нм и 470 нм) с обработкой AZT или без нее.Изображения в B и E: верхний ряд, необработанная первичная бронхиальная клетка МВ; нижний ряд — первичная бронхиальная клетка МВ, обработанная АЗТ. Таблица поиска цвета, соотношение интенсивности излучения R (410/470) на длине волны 508 нм при освещении 410 и 470 нм. C, TGN pH в клетках IB3-1 (CF) с обработкой AZT или без нее, или в S9 (клетки IB3-1 с поправкой на CFTR). D, коррекция pH TGN в первичных клетках респираторного эпителия CF с помощью AZT. E, ратиометрические флуоресцентные изображения с целлубревином-GFP pHluorin в первичных респираторных эпителиальных клетках CF из трансплантата легкого.F, коррекция с помощью AZT pH эндосомы целлубреина в клетках CF (IB3-1). G. Коррекция с помощью AZT pH в эндосомах целлубревина в первичных респираторных эпителиальных клетках CF, трансплантат легкого, P (ANOVA), * <0,05; ** <0,01, n = 6.
pH рециркулирующей эндосомы при CF аналогичным образом скорректировали с помощью AZT (рис. 1E-G). Обработка IB3-1 (клетки CF) 100 мкМ AZT в течение 1 ч или 1 мкМ в течение 48 ч приводила к корректировке pH RE с 6,1 ± 0,3 до 6,8 ± 0,2 (рис. 1F). В первичных бронхиальных клетках CF 100 мкМ AZT скорректировали pH RE с 6.1 ± 0,1 до pH 6,7 ± 0,2 (рис. 1E, G).
Ацидотропная коррекция подкисленных внутриклеточных компартментов в респираторных эпителиальных клетках МВ не ограничивается азитромицином
CPX, другой антибиотик (фторхинолон) (рис. 2), эффективный при МВ, также является слабым основанием с pKa 8,76 37 . Мы протестировали влияние CPX на клетки CF. Мы использовали клетки pCEP-R, нормальные эпителиальные клетки бронхов человека (16HBE), трансфицированные R-областью CFTR, что делает их фенотипически выраженными характеристиками CF, и обнаружили, что CPX (100 мкМ, 1 час) скорректировал pH в TGN (рис. .2). Это показывает, что коррекция pH при CF не ограничивается зидовудином, но другие антибиотики со слабыми основными химическими свойствами могут проявлять это свойство.
Рисунок 2. Ципрофолксацин повышает pH TGN в клетках pCEP-R.Фенотипические клетки CF (pCEP-R) трансфицировали TGN38-GFP pHlourin. Трансфицированные клетки обрабатывали 10 мкМ CPX в течение 1 ч и определяли pH ратиометрически, как в исследованиях с AZT. pCEP, нормальные клетки.
Азитромицин корректирует клеточно-автономные свойства, связанные с врожденным иммунитетом, и ответы клеток CF
Клинические исследования показали, что приверженность P.aeruginosa в эпителии пациентов с МВ, получающих терапию зидовудином, снижается 38 . Основываясь на наших выводах о том, что AZT корректирует закисление TGN в клетках CF, мы исследовали, влияет ли AZT на недостаточное сиалирование aGM1 и снижение бактериальной адгезии к эпителиальным клеткам легких при CF. Было высказано предположение, что недостаточное сиалирование и снижение связывания токсина холеры было одним из эволюционных драйверов для появления мутаций CFTR в человеческих популяциях, и что это можно объяснить, по крайней мере частично, гиперакислением TGN и результирующим субоптимальным распределением. или активность сиалилтрансфераз и других гликозилирующих ферментов в этой органелле 29,39 .CF и нормальные клетки выращивали в течение 14 дней после слияния с последующей 48-часовой обработкой монослоев 1-100 мкМ AZT. Монослои анализировали на связывание субъединицы B холерного токсина (CTB), конъюгированной с флуорофором FITC (CTB связывается преимущественно с сиалированными гликоконъюгатами) (фиг. 3A). Используя связывание CTB с клетками S9 (клетки IB3-1 с коррекцией CFTR) как 100% и связывание с клетками IB3-1 (CF) как 0%, обработка монослоев IB3-1 1-100 мкМ AZT увеличивала CTB-FITC связывание с уровнями, приближающимися к уровням не-CF S9 клеток (рис.3А). Как и в случае коррекции pH TGN-38, влияние AZT на коррекцию связывания CTB не зависело от концентрации, как и ожидалось от накопления ацидотропного агента и его внутриорганелларного захвата после его протонирования.
Рис. 3. AZT корректирует аберрантные клеточно-автономные свойства врожденного иммунитета и ответы в респираторных эпителиальных клетках МВ.A. Связывание токсина холеры (флуоресценция CTB-FITC; используется в качестве зонда aGM1) с монослоями CF и нормальных клеток, выращенных в течение 14 дней после слияния и обработанных или не обработанных азитомицином (48 ч).IB3-1, клеточная линия CF; S9, клетки CFTR-ciorrecetd IB3-1. B и C. P. aeruginosa (MOI 1: 200) прикрепление к IB3-1 (CF) или pCepR-16HBE (нормальные эпителиальные клетки бронхов человека, визуализированные CF посредством экспрессии R-домена CFTR), предварительно обработанные или необработанные монослои с AZT (препарат отсутствовал в тесте на адгезию). D. AZT снижает активацию NFκB (репортер люциферазы) в клетках CF (IB3-1) в ответ на лиганд P. aeruginosa TLR2, полученный из липопротеина LptA. E и F, AZT снижает базальную секрецию IL-8 и IL-8, индуцированную обработкой P.aeruginosa ДНК. G, AZT снижает базальную продукцию RANTES клетками CF (IB3-1). ** P (ANOVA; n = 6) <0,05.
Затем мы протестировали действие AZT на адгезию P. aeruginosa к клеткам CF. Мы использовали AZT в 200 раз меньшей концентрации (1 мкМ), чем его МИК (170 мкМ) против P. aeruginosa 40 . Кроме того, монослои промывали для удаления внеклеточного AZT во время анализа бактериальной адгезии. Предварительная обработка клеток IB3-1 (CF) 1 мкМ AZT привела к снижению P.aeruginosa на 85 ± 3% (рис. 3В). Этот результат был подтвержден с использованием клеток pCEP-R, нормальных эпителиальных клеток бронхов человека 16HBE, трансфицированных R-областью CFTR. Предварительная обработка клеток pCEP-R (CF) 1 мкМ AZT привела к снижению связывания P. aeruginosa на 75 ± 7% (n = 6, P = 0,0002) (рис. 3C), подтверждая результаты с IB3-1 клетки CF.
AZT корректирует иммунный ответ клеток CF на воздействие бактериальных продуктов
Мы проверили влияние AZT на общепринятый провоспалительный фенотип клеток респираторного эпителия при CF 41–44 путем измерения NFκB, TGF-β , IL-8 и ответы RANTES.Когда клетки IB3-1 обрабатывали 100 мкМ AZT, базальная активация NFκB снижалась на 50 ± 8% по сравнению с необработанными клетками. Когда CF-клетки (IB3-1) стимулировали липопептидом P. aeruginosa (LptA) в течение 6 часов в присутствии 100 мкМ AZT, макролид ослаблял усиление стимуляции NFκB в ответ на LptA на 40% (рис. 3D). ). Эти результаты согласуются с сообщениями о том, что AZT 42 и слабые основания (хлорохин) или ингибиторы (бафиломицин A 1 ) вакуолярной H + АТФазы 45 улучшают провоспалительную передачу сигналов в клетках CF.
Уровни IL-8 увеличиваются в CF 41,43,44,46–48 , и это увеличение IL-8 может быть скорректировано обработкой слабыми основаниями, такими как хлорохин 45 . Мы протестировали действие AZT на высвобождение IL-8 в базовых условиях и при стимуляции ДНК P. aeruginosa . Обработка CF-клеток с помощью AZT от 1 до 100 мкМ снижала базальную секрецию IL-8 почти на 70% (фиг. 3E). Стимуляция выработки ИЛ-8 добавлением ДНК P. aeruginosa приводила к 5-кратному увеличению секреции ИЛ-8 (нестимулированный = 55 пг ИЛ-8/100 мкг белка по сравнению сСтимулированная ДНК = 240 мкг IL-8/100 мкг белка). Предварительная обработка стимулированных клеток AZT снижала секрецию IL-8 (10 мкМ AZT 33 ± 7%, 10 мкМ AZT 34 ± 10%) (фиг. 3F). Как и в случае с другими анализами, концентрация AZT в среде не была критичной для получения эффектов, хотя более длительное время предварительной инкубации (например, 24-48 часов для 1 мкМ AZT по сравнению с 1-4 часа для 100 мкМ AZT) требовалось при более низких концентрациях. . Важно отметить, что такое поведение подтверждает действие AZT как слабого основания, которое накапливается в закисленных внутриклеточных органеллах, которые действуют как сток для улавливания AZT при его протонировании.Кроме того, было измерено влияние AZT на базальные уровни RANTES 45 , и AZT снижал секрецию RANTES (фиг. 3G).
AZT корректирует активность фурина и уровни TGF-β в клетках CF
Генетические полиморфизмы 49 , связанные с повышенным уровнем профибротического медиатора TGF-β, являются ключевыми модификаторами заболевания при CF, при этом повышенный TGF-β увеличивает тяжесть заболевания 50–53 . Мы сообщали, что TGF-β, генерируемый клетками респираторного эпителия CF, увеличивается по сравнению с нормальными клетками и что обработка CQ со слабым основанием может корректировать высвобождение TGF-β 27,33 .Когда тестировали AZT, он также уменьшал TGF-β (рис. 4A). Мы сообщили, что повышенный TGF-β в клетках CF вызван повышенной активностью фурина во внутриклеточных органеллах респираторных эпителиальных клеток CF 27 . Таким образом, мы проверили, влияет ли АЗТ на дисбаланс фурина. Когда клетки CF инкубировали со 100 мкМ AZT, продукция активного фурина в клетках CF нормализовалась наравне с обработкой CQ и на уровне клеток S9 с коррекцией CFTR (фиг. 4B). Эти результаты показывают, что корректировка pH органелл с помощью AZT нормализует чрезмерную переработку и активацию фурина в клетках CF.Таким образом, преимущества AZT при CF, которые не могут быть объяснены его прямой антибиотической активностью, связаны с его физико-химическим действием как слабого основания, нормализующего функцию органелл и клеточно-автономных ответов респираторных эпителиальных клеток при CF.
Рисунок 4. AZT снижает продукцию TGF-β и активность фурина в респираторных эпителиальных клетках МВ.A. Влияние AZT на секрецию TGF-β клетками CF (IB3-1). B. Уровни фурина корректировали в полной среде с помощью AZT или 0,1 мМ хлорохина (CQ). 50 мкМ ингибитор фурина CMK использовали в качестве меры максимального ингибирования фурина.* P <0,01, ** P <0,05 (ANOVA, n = 6).
Фармакологические соображения о значимости COVID-19
Выбранные свойства альтернативных препаратов AZT и CPX показаны в таблице 1 вместе со свойствами CQ и HCQ. Все являются гидрофобными слабыми основными лекарственными средствами с рКа амина от 8,2 до 10,1 в соответствии с их предполагаемым общим механизмом. Количество абсорбированного основания на 100 мг соединения также рассчитывается, и в сочетании с типичными диапазонами дозировок и графиками показывает, что общие вероятные количества основания для нейтрализации внутриклеточной кислоты для каждого из них аналогичны по количеству для HCQ, AZT и CPX.
Таблица 1.Избранные свойства исследуемых препаратов.
Выводы и перспективы
В заключение, взаимосвязи, продемонстрированные в этом исследовании, показывают, что набор одобренных FDA препаратов, CQ, AZT, CPX, с известными профилями безопасности, действует, контролируя pH внутриклеточных органелл в клетках респираторного эпителия, a очень актуальная цель для CoV2. Кроме того, наши предыдущие исследования ингибиторов фосфодиэстеразы 5 показывают аналогичные эффекты, и они также могут быть дополнительно протестированы. 30
Изменения pH в органеллах секреторного пути, особенно TGN 31 , могут изменять гликозилирование обоих рецепторов CoV2, таких как ACE2, который связывает спайковый белок, и гликозилирование белков CoV2 во время их биогенеза. и сборка. Важно отметить, что белки коронавируса M регулируют почкование вируса в промежуточном компартменте ER-to-Golgi, но проникают глубже в аппарат Гольджи 54 , и среди патогенных CoV, по крайней мере, белок M MERS CoV обладает сигналами локализации TGN 55 .Эффекты хлорохина наблюдались с другими вирусами, включая дефект гликозилирования gp120 ВИЧ и потерю инфекционности 56,57 , а также остановку неинфекционных сторон вирусом простого герпеса в TGN 58 . Наши исследования показывают, что нормализация клеток респираторного эпителия при МВ основана на нейтрализации уже существующих патологически гиперацидных компартментов из-за основного заболевания МВ, что приводит к нормализации гликозилирования в клетках респираторного эпителия при МВ.Мы постулируем здесь, что ацидотропный и нейтрализующий эффекты AZT, CPX и CQ в нормальных клетках приведут к векторно подобным сдвигам pH от оптимального для функции ферментов секреторного пути, что также изменит гликозилирование.
Изменения pH в органеллах эндосомного пути могут влиять на протеазы хозяина, действующие на белок CoV2 Spike, чтобы выполнить его расщепление, необходимое для проникновения вируса. Ингибирование проникновения вируса в современные клеточные системы лучше всего достигается с помощью комбинации мезилата камостата (ингибитора протеазы TMPRSS2) плюс E-64d, ингибитора лизосомальных катепсинов 59 .Было отмечено, что CoV2, в отличие от SARS-CoV, обладает новым сайтом расщепления фурином в своем белке Spike 60 . Наши исследования показывают, что AZT может снижать активность фурина, который в изобилии присутствует в клетках респираторного эпителия. Предлагается несколько протеаз для расщепления CoV2 Spike, включая TMPRSS2 59 (который также действует на SARS-CoV 61–63 ), фурин 60 и лизосомальные гидролазы 59 . Это требует рассмотрения более общего подхода к их ингибированию, такого как изменение pH, а не сосредоточения внимания исключительно на конкретной протеазе хозяина.Мы предполагаем, что препараты, изучаемые здесь, CQ, AZT и CPX, могут модулировать эти аспекты взаимодействия хозяин-патоген и инфекционный цикл вируса с немедленным использованием в клинике или в контролируемых клинических испытаниях. Подтверждение эффектов CPX у пациентов с COVID-19 позволит использовать этот препарат для уменьшения вероятной нехватки HCQ и AZT. CPX является частью стратегического национального резерва здравоохранения и социальных служб США 64 , который можно мобилизовать во время региональных или национальных чрезвычайных ситуаций.
Методы
Клетки, культура тканей и химические вещества
IB3-1 представляет собой линию эпителиальных клеток бронхов, полученную от пациента с МВ с генотипом мутанта ΔF508 / W1282X CFTR 65 . S9 является производным IB3-1, скорректированным на хлоридную проводимость путем стабильной трансфекции функциональным CFTR . Клетки поддерживали в среде LHC-8 (Biosource Int., MD). Клеточная линия CFBE41ō (ΔF508 / ΔF508) и нормальные эпителиальные клетки бронхов человека 16HBEō (из D.Gruenert) поддерживали в полной среде MEM (GibcoBRL, Life Technologies, MD). Линия нормальных трахеальных клеток человека 9HTEō, трансфицированная pCEP-R или pCEP, была получена от P. Davis и содержалась в полной среде DMEM (GibcoBRL, Life Technologies, MD). Первичные бронхиальные эпителиальные клетки были от Clonetics (NHBE) или от P. Karp (трансплантаты легких CF) и поддерживались в BEMB с добавками (Lonza, MD). AZT был от Fluke (Швейцария), а CPX-HCL был от Sigma (Сент-Луис, Миссури).
Трансфекция и микроскопия
Слияние TGN38 и целлубревина с pH-чувствительным GFP получено от J.Ротман 36 . Клетки трансфицировали ДНК с концентрацией 1 мкг / мл с использованием Effectene (Siegen, CA) в течение 48 часов перед измерением pH. Софокальную флуоресцентную микроскопию фиксированных образцов проводили на микроскопе Zeus 510 META.
Ратиометрическое определение pH
Отношение испускания при 508 нм при возбуждении на 410 нм к 470 нм было получено, как описано ранее 28,34–36 . Стандартная кривая pH была построена путем уменьшения градиента pH путем инкубации клеток в 10 мкМ монензина и 10 мкМ нигерицина в течение 30 мин при 37 ° в буфере при pH 7.4, 6,5 или pH 5,5 и отношения были записаны для внутренних стандартов. Флуоресцентные изображения получали при возбуждении при 410 и 470 нм (6 последовательных экспозиций). Были выбраны три представляющих интерес области, и стандартная кривая была построена как усредненные значения отношения 410/470 для данного pH буфера. Клетки инкубировали с 1-100 мкМ AZT в течение 1 или 48 часов до определения pH. Соотношение 410/470 образцов считывали по стандартной кривой и переводили в единицы pH.
Адсорбция холерного токсина эпителиальными клетками легких при CF,
P.aeruginosa , адгезия к клеткам респираторного эпителия CF, активация NF-κB, IL-8 и измерения RANTES.CF и нормальные клетки, выращенные до постконфлюэнтности, инкубировали в течение 48 часов с 1-100 мкМ AZT. Клетки фиксировали и окрашивали флуоресцентно меченным холерным токсином В в течение 1 ч при комнатной температуре. Относительная флуоресценция была рассчитана по фактическим уровням серого в 10 случайных полях из 3 независимых экспериментов. Постконфлюэнтные клетки, обработанные 1-100 мкМ AZT, инкубировали с P.aeruginosa (PAO1) при множественности инфицирования 1: 200 в среде MEM без сыворотки или добавок антибиотиков. Образцы промывали 3 раза PBS и лизировали 0,5% TX-100. Бактерии, ассоциированные с клетками, высевали на агаре для изоляции P. aeruginosa и подсчитывали колонии. Лечение провоспалительным липопептидом (липотоксином) Pseudomonas Lepta, активация NF-κB (анализ люциферазы), анализ IL-8 и RANTES проводили, как описано ранее 45,66 .
Анализ продукции TGF-β и активности фурина. Уровни TGF-β определяли с использованием анализа PAI / L, как описано ранее 67 . Активность фермента фурина оценивали в присутствии 0,25% Triton X-100 в качестве агента, повышающего проницаемость, с использованием boc-RVRR-amc (100 мкМ) в качестве субстрата фурина. Флуоресценцию измеряли при длинах волн возбуждения 380 нм и эмиссии 460 нм. Ингибирующую концентрацию dec-RVKR-cmk (Calbiochem) для ExoA-опосредованной гибели клеток оценивали, и в последующих экспериментах использовали 50 мкМ.
Статистика. Если не указано иное, статистический анализ проводили с использованием апостериорного теста Fisher’s Protected LSD (ANOVA) (SuperANOVA, Abacus Concepts).
Дыхательный тест с 13 [c] мочевиной как новый биомаркер для лечения и диагностики туберкулеза — Университет Джона Хопкинса
@article {2859e7ac64d84b579b1259837c266771,
title = «13 [c] -мочевина в качестве теста новый биомаркер для лечения и диагностики туберкулеза «,
abstract =» Общие сведения: патоген-специфические метаболические пути могут быть обнаружены с помощью дыхательных тестов, основанных на введении стабильных изотопно-меченых субстратов и обнаружении меченых продуктов в выдыхаемом воздухе портативные инфракрасные спектрометры.Методология / основные результаты. Мы проверили, можно ли использовать микобактериальную уреазную активность в таком формате дыхательного теста в качестве основы для нового биомаркера и диагностики легочного туберкулеза. Сенсибилизированные новозеландские белые кролики перенесли бронхоскопическую инфекцию Mycobacterium bovis или Mycobacterium tuberculosis. Кроликов лечили 25 мг / кг изониазида (INH) примерно через 2 месяца после заражения, когда присутствовала значительная полостная патология легких. [13C] мочевина закапывалась непосредственно в легкие интубированных кроликов в выбранные моменты времени, анализировались пробы выдыхаемого воздуха и определялась кинетика образования δ13CO2.Образцы, полученные до инокуляции, служили контрольными образцами для фоновой конверсии 13CO2 в модели кролика. 13CO2, образующийся в результате метаболического превращения [13C] -мочевины микобактериальной уреазной активностью, легко обнаруживался в выдыхаемом воздухе инфицированных кроликов в течение 15 минут после введения. Анализы показали быстрое увеличение скорости образования 13CO2 как на ранних стадиях заболевания, так и до лечения INH. После лечения INH у всех исследуемых кроликов наблюдалось снижение скорости образования 13CO2.Выводы / значение: Дыхательный анализ мочевины может обеспечить полезный диагностический и биомаркерный анализ туберкулеза и ответа на лечение. В будущих исследованиях будет проведена проверка специфичности для M. tuberculosis с использованием ингаляционных препаратов сухого порошка, нацеленных на легкие, в сочетании с одновременным введением пероральных ингибиторов уреазы вместе с насыщающей пероральной дозой немеченой мочевины, что предотвратит сигнал δ 13CO2 от уреазо-положительных желудочно-кишечных организмов. «,
author =» Джассал, {Мандип С.} и Недельчев, {Гено Г.} и Ли, {Чон Хи} и Чой, {Сон Вон} и Виорел Атудорей, и Шарп, {Закари Д.} и Воджо Деретич и Тимминс, {Грэм С.} и Бишай, {Уильям R.} «,
note =» Авторское право: Copyright 2011 Elsevier BV, Все права защищены. «,
год =» 2010 «,
doi =» 10.1371 / journal.pone.0012451 «,
language =» Английский (США) «,
volume =» 5 «,
journal =» PLoS One «,
issn =» 1932-6203 «,
publisher =» Public Library of Science «,
number =» 8 «,
}
.
 У нас она 11, то есть, на данный момент, она самая новая.
У нас она 11, то есть, на данный момент, она самая новая.